- Proszę czekać...
Zastosowanie autologicznej bioaktywnej matrycy fibrynowej w medycynie

Rehabilitacja – jak zadbać o pacjenta i rozwój placówki?
12.11.2024
Rezonans magnetyczny w placówkach medycznych pod ręką!
11.02.2025Artykuł skierowany jest do kardiochirurgów, chirurgów ogólnych, chirurgów szczękowo-twarzowych/laryngologicznych, neurochirurgów, chirurgów ortopedycznych, chirurgów klatki piersiowej, urologów i chirurgów klatki piersiowej.
Czytając artykuł, znajdziesz odpowiedzi na pytania:
- Z jakich komponentów składa się Vivostat®?
- Jakie są rodzaje aplikatorów autologicznych, bioaktywnych matryc fibrynowych?
- Jak przygotować autologiczną, bioaktywną matrycę fibrynową?
- Jakie są zagrożenia związane z podaniem sztucznej trombiny?
- W jakich przypadkach można zastosować Vivostat®?
- Jakie są rodzaje roztworów fibryny bogatopłytkowej i do jakich zabiegów je wykorzystać?
Autologiczna, bioaktywna matryca fibrynowa
Vivostat® jest systemem do przygotowania i aplikacji autologicznych, bioaktywnych matryc fibrynowych bez konieczności stosowania oddzielnego składnika – trombiny.
Autologiczna matryca fibrynowa jest uzyskiwana z własnej krwi pacjenta i wykazuje biokompatybilność. W przeciwieństwie do konwencjonalnych produktów, które są najczęściej oparte na krwi lub składnikach bydlęcych i syntetycznych, autologiczna natura Vivostat® skutecznie eliminuje ryzyko zanieczyszczeń pochodzących od bydła lub ludzi. Jest to jedyny sposób ochrony pacjenta przed chorobami wirusowymi, które nie zostały jeszcze zidentyfikowane.
System składa się z trzech komponentów:
Procesor – służy do przetwarzania krwi pacjenta i przygotowywania roztworu fibryny.
Cechy
- Wyświetlacz na bieżąco informuje użytkownika o przebiegu procesu.
- Jednostka procesora może być umieszczona w dowolnym pomieszczeniu lub korytarzu na oddziale operacyjnym. Najczęściej procesor umieszczany jest centralnie pomiędzy salami operacyjnymi. W ten sposób jeden urządzenie może zaopatrywać kilka sal operacyjnych.
- Jednostka procesorowa jest obsługiwana za pomocą jednego przycisku, a wyświetlacz przez cały czas informuje pielęgniarkę o czasie pozostałym do zakończenia procesu i jego statusie.
- Nie jest wymagana specjalna instalacja, a duży rozstaw osi ułatwia przemieszczanie.
Aplikator – kontroluje dostarczanie matrycy fibrynowej do miejsca operowanego i oferuje wiele różnych trybów natryskiwania.
Cechy
- Aplikator umożliwia podawanie leków lub komórek razem z matrycą fibrynową.
- Jest niesterylnym, wielorazowym, w pełni zautomatyzowanym urządzeniem, które kontroluje podawanie uszczelniacza fibrynowego.
- 4 różne aplikatory.
Poznaj rodzaje dostępnych aplikatorów
1. Spraypen
Zapewnia chirurgowi do 4 minut ciągłego natryskiwania z zaledwie 5 ml Vivostat® Fibrin lub Vivostat PRF®. Daje chirurgowi swobodę bardzo dokładnego umieszczenia roztworu w miejscu docelowym zamiast w otaczającej tkance, co jest istotne w przypadku aplikacji punktowych, mikro zespoleń i trudno dostępnych obszarów.
2. Spraypen Concorde
Jest stosowany w szerokim zakresie procedur chirurgicznych. Dzięki zoptymalizowanemu kątowi końcówki rozpylającej używany jest do stosowania np. uszczelniacza fibrynowego w zespoleniach na tylnej ścianie serca, uszczelniania łożyska śluzówki macicy i niektórych rodzajów operacji brzusznych w trudno dostępnych narządach.
3. Aplikator endoskopowy 5,0mm
Jednorazowy cewnik do aplikacji endoskopowej jest łatwo ładowany do uchwytu aplikatora endoskopowego (wielokrotnego użytku), a uchwyt jest wprowadzany przez trokar 5 mm. Podczas korzystania z aplikatora endoskopowego, roztwór Vivostat® jest aplikowany przez tę samą unikalną dyszę, która jest również używana z aplikatorem Spraypen. Pozwala to chirurgowi na stosowanie roztworu w sposób precyzyjny i ukierunkowany przez cały czas trwania zabiegu, bez doświadczania zatorów. Ze względu na wstępnie uformowaną dyszę, końcówką rozpylającą można łatwo manipulować w wielu kierunkach, co daje niezrównaną swobodę w kontroli aplikacji, nieosiągalną w przypadku konwencjonalnych systemów aplikacji.
4. Aplikator endoskopowy 2,4mm – prosty
Został opracowany do aplikacji w głębokich ranach i przetokach. W połączeniu ze specjalnie zaprojektowanymi trybami rozpylania dla jednostki aplikatora, cewnik całkowicie wypełnia rany i przetoki bez pozostawiania pustych przestrzeni. Podczas korzystania z aplikatora endoskopowego uszczelniacz fibrynowy lub roztwór PRF® jest aplikowany przez tę samą unikalną dyszę, która jest również używana z Vivostat® Spraypen. Pozwala to chirurgowi na aplikację roztworu w precyzyjny i ukierunkowany sposób przez cały czas trwania zabiegu, bez doświadczania zatorów. Podczas korzystania z aplikatora endoskopowego, aplikacja fibryny lub PRF® jest aktywowana za pomocą przełącznika nożnego.
Zestaw jednorazowego użytku – zawiera wszystkie elementy potrzebne do przygotowania i aplikacji matrycy fibrynowej Vivostat®.
Cechy
- Jest dostępny z szeregiem urządzeń aplikacyjnych zoptymalizowanych pod katem różnych procedur chirurgicznych.
Przygotowanie autologicznej matrycy fibrynowej bez konieczności stosowania oddzielnego składnika – trombiny. Co to dokładnie oznacza?
Matryca fibrynowa to rodzaj naturalnego opatrunku, który tworzy się w ciele, głównie wtedy, gdy zranimy skórę lub tkanki. Po skaleczeniu krew zaczyna krzepnąć, a fibryna – białko znajdujące się we krwi – tworzy sieć włókien. Ta sieć, czyli właśnie matryca fibrynowa, działa jak naturalny plaster, bo zatrzymuje krwawienie i daje tkankom czas na regenerację. Dzięki matrycy fibrynowej małe rany są w stanie samoistnie się zagoić.
Autologiczna matryca fibrynowa tworzona jest z własnej krwi pacjenta, a proces jej powstawania nie wymaga dodawania dodatkowej trombiny. Trombina jest enzymem, który w naturalnych warunkach w organizmie przekształca fibrynogen (rozpuszczalne białko) w fibrynę (włóknista sieć). W niektórych procesach medycznych, aby stworzyć matrycę fibrynową, dodaje się trombinę z zewnątrz, aby przyspieszyć krzepnięcie.
System Vivostat® (Vivostat® – System do przygotowania i aplikacji autologicznych, bioaktywnych matryc fibrynowych) umożliwia stworzenie matrycy fibrynowej bez konieczności dodawania trombiny (w przeciwieństwie do większości innych konwencjonalnych produktów).

Jak stworzyć autologiczną matrycę fibrynową? 3 kroki
- Pobranie krwi od pacjenta
W czasie zabiegu lub do 24 godzin przed, cytrynian (dostarczony z zestawem) jest dodawany do jednostki przygotowawczej. Do tej samej jednostki pobiera się następnie 120 ml własnej krwi pacjenta.
- Przetworzenie krwi pacjenta
Jednostka przygotowawcza jest umieszczana w jednostce procesora. Po naciśnięciu przycisku rozpoczyna się proces. Po około 25 minutach autologiczny uszczelniacz fibrynowy lub autologiczna matryca fibrynowa bogatopłytkowa jest gotowa do użycia. Do krwi nie dodaje się trombiny ani składników bydlęcych.
- Załadowanie aplikatora i spryskanie
Autologiczny roztwór uszczelniający/matrycowy można łatwo załadować do aplikatora i nałożyć na miejsce operacyjne za pomocą jednego z 4 urządzeń aplikacyjnych.
Sztuczna trombina – sposoby jej podawania i zagrożenia z tym związane
Sztuczna trombina jest enzymem stosowanym w medycynie w celu przyspieszenia procesu krzepnięcia krwi np. podczas operacji chirurgicznych, zabiegów stomatologicznych lub przy tworzeniu klejów chirurgicznych, takich jak matryca fibrynowa. Jest najczęściej podawana miejscowo, bezpośrednio na ranę lub miejsce, w którym konieczne jest przyspieszenia procesu krzepnięcia.
Sposoby podawania sztucznej trombiny
- Miejscowo: Najczęściej stosowana jest w postaci żelu, roztworu, proszku lub jako składnik klejów fibrynowych. Nakładana jest bezpośrednio na ranę lub obszar krwawienia, co przyspiesza tworzenie skrzepu.
- W połączeniu z innymi materiałami: Trombina może być dodawana do gąbek chirurgicznych, matryc lub innych narzędzi, które wspierają kontrolę krwawienia.
Zagrożenia związane z podaniem sztucznej trombiny
- Reakcja alergiczna: Sztuczna trombina może wywołać reakcje alergiczne m.in. wysypkę, świąd, a w poważniejszych przypadkach nawet wstrząs anafilaktyczny.
- Problemy z krzepnięciem krwi: Nadmierne stosowanie trombiny może prowadzić do niekontrolowanego tworzenia się skrzepów krwi w miejscach, gdzie nie jest to pożądane.
- Ograniczona skuteczność: W niektórych przypadkach pacjenci mogą rozwinąć przeciwciała przeciwko trombinie (np. po wielokrotnym jej stosowaniu), co sprawia, że przyszłe zastosowanie może być mniej skuteczne.
Fibryna autologiczna przewyższa inne uszczelniacze fibrynowe pod względem kluczowych parametrów, takich jak polimeryzacja, elastyczność, adhezja i jej wpływ na tkankę.
Korzyści z korzystania z systemu Vivostat®
- Skraca czas gojenia, pobytu w szpitalu oraz zmniejsza liczbę reoperacji.
- Zapewnia w pełni zautomatyzowane przetwarzanie krwi pacjenta, tworząc gotowy do użycia autologiczny roztwór.
- Jednostka aplikująca umożliwia wyjątkową aplikację, oferując liczne korzyści kliniczne oraz szeroki wybór trybów natrysku i urządzeń aplikacyjnych, dopasowanych do każdego rodzaju zabiegów.
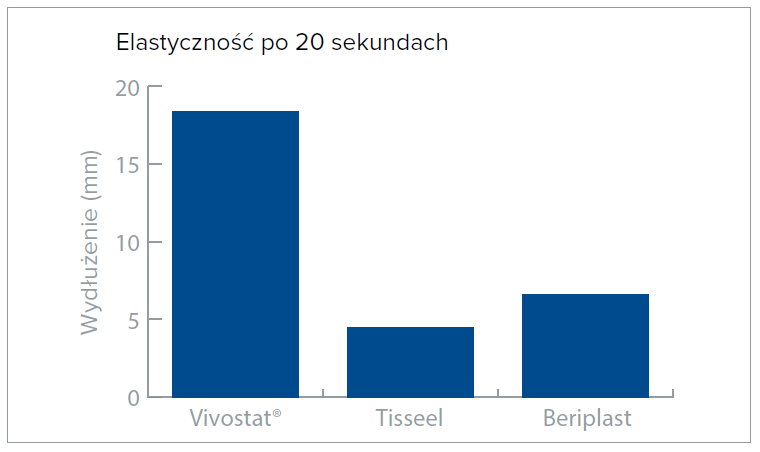
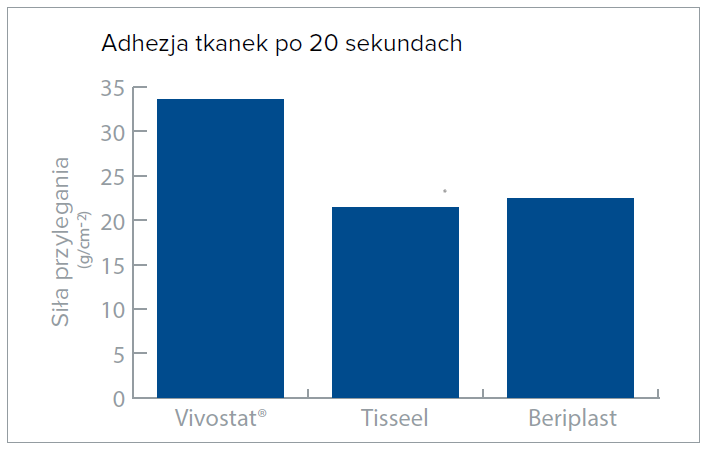
Badania kliniczne i testy porównawcze wykazały, ze matryca fibrynowa Vivostat® przewyższa inne konwencjonalne produkty pod względem ważnych parametrów, takich jak czas do hemostazy, elastyczność, adhezja do tkanki i wpływ na tkankę.
Vivostat® w praktyce – poznaj jego zastosowanie
Kardiochirurgia
- Pomostowanie aortalno-wieńcowe (CABG)
- Rekonstrukcja aorty
- Kardiochirurgia wad wrodzonych
- Implantacja protez naczyniowych
- Operacja aktywnego zapalenia wsierdzia korzenia aorty
- Rozwarstwienie aorty typu A
- Głębokie zakażenia rany mostka
- Zabiegi wszczepienia systemu wspomagania lewokomorowego (LVAD)
- Operacje u pacjentów wysokiego ryzyka, tj. pacjentów leczonych przeciwzakrzepowo, klopidogrelem i pacjentów z cukrzycą
Chirurgia ogólna
- Zespolenie okrężniczo-odbytnicze
- Rekonstrukcja przełyku
- Przetoki okołoodbytnicze
- Resekcja trzustki
- Resekcja wątroby (hepatektomia) i przeszczepy
Chirurgia szczękowo-twarzowa/laryngologiczna
- Martwica kości szczęk związana z przyjmowaniem bisfosfonianów (BRONJ)
- Mukowiscydoza
- Chirurgia endoskopowa
- Chirurgia laryngologiczno-onkologiczna
- Chirurgia urazowa twarzy
- Leczenie nowotworów jamy ustnej/głowy i szyi
- Chirurgia zatok
Neurochirurgia
- Operacje na otwartej czaszce
- Chirurgia przezklinowa (przeznosowa)
- Zamknięcie opony twardej/wyciek płynu mózgowo-rdzeniowego (PMR)
- Naprawa ubytków opony twardej
- Rekonstrukcje kręgosłupa
- Odbarczenie tylnego dołu czaszki przy malformacji Chiariego
- Zespolenia nerwów
Chirurgia ortopedyczna
- Artroskopia – medycyna sportowa:
- Kolano – naprawa łąkotek, rekonstrukcja więzadła krzyżowego przedniego (ACL)
- Kolano – zmiany chrzęstne
- Biodro – konflikt udowo-panewkowy (FAI)
- Ramię – stożek rotatorów
- Kostka – zmiany chrzęstne
- Wymiana stawów
- Kolana
- Biodra
- Zabiegi rewizyjne
- Nacieki w stawach, ścięgnach i więzadłach
- Leczenie ran w ortopedii
Chirurgia klatki piersiowej
- Lobektomia
- Operacja zmniejszenia objętości płuc (OZOP)
- Resekcje klinowe
- Bullektomia – wycięcie pęcherzy rozedmowych
- Samoistna odma opłucnowa
- Resekcje płucne
Urologia
- Częściowa nefrektomia
- Prostatektomia radykalna
- Przeszczep nerki
- Zabieg pieloplastyki
- Cystektomia
- Epizody krwotoczne z pęcherza moczowego
- Wypadanie narządów miednicy
- Usunięcie siatki podtrzymującej narządy rodne
- Zespolenie moczowodu
Badanie
Wpływ autologicznego uszczelniacza fibrynowego (Vivostat®) na zachorowalność po lobektomii płucnej: prospektywne, randomizowane badanie, z próbą ślepą
Ali Belboul, Leif Dernevik, Obaid Aljassim, Biljana Skrbic, Go¨ ran Ra˚dberg, Donald Roberts
Department of Cardiothoracic Surgery, Sahlgrenska University Hospital, Go¨teborg 413 45, Szwecja, 15 sierpnia 2004 r
- Streszczenie
Cel badania: Pooperacyjny przeciek powietrza jest najczęstszym powikłaniem po operacji płuc. Na rozwój nowoczesnych technik chirurgicznych duży wpływ miała potrzeba opracowania skutecznego postępowania w przypadkach przecieków powietrza w wyniku resekcji płuca. W niniejszym badaniu oceniono wpływ zastosowania autologicznego uszczelniacza fibrynowego (Vivostat®) podczas lobektomii na zachorowalność po operacji.
Metody: W prospektywnym, zaślepionym, randomizowanym badaniu klinicznym pacjentów z zaplanowaną lobektomią włączono do jednej z dwóch grup: do grupy z Vivostat lub do grupy kontrolnej bez leczenia, po 20 pacjentów w każdej grupie. Przeciek powietrza mierzono przez 1 h (przy użyciu mechanicznej pompy ssącej) w dniu operacji, a zarówno wielkość przecieku powietrza, jak i krwawienia / wysięku (objętość drenażu) rejestrowano każdego dnia rano po operacji, aż do usunięcia drenów piersiowych. Personel rejestrujący te parametry nie znał przynależności pacjentów do grup badawczych.
Wyniki: W porównaniu z grupą kontrolną, średnie objętości krwawienia / wysięku były znacząco mniejsze w grupie Vivostat (dzień 1.: 370 ml vs. 525 ml; ogółem: 424 ml vs. 782 ml; w obu grupach P˂0,001). Również dreny w grupie Vivostat były usuwane po krótszym czasie (mediany: 1 dzień vs. 2 dni, P = 0,07). Znacznie mniej pacjentów miało przeciek powietrza w dowolnym momencie w grupie Vivostat (40% vs. 80%, P = 0,02). Również objętości przecieku powietrza w grupie Vivostat były istotnie mniejsze w porównaniu z grupą kontrolną ( różnice mediany: w dniu operacji: 0,6 l/min, P = 0,01; całkowita 0,8 l/min, P = 0,03). Pooperacyjny czas hospitalizacji był krótszy w grupie Vivostat niż w grupie kontrolnej, ale różnica nie była znacząca (0,5 dnia, P = 0,12).
Wnioski: Uszczelniacz fibrynowy Vivostat® znacząco zmniejsza pooperacyjny przeciek powietrza i objętość drenażu po lobektomii i nadaje się do rutynowego stosowania w tej procedurze.
- Materiały i metody
Niniejsze badanie prospektywne przeprowadzono na Oddziale Kardiochirurgii Szpitala Uniwersyteckiego Sahlgrenska w Goteborgu w okresie od stycznia 2002 roku do grudnia 2003 roku. Do badania włączono czterdziestu kolejnych dorosłych pacjentów z guzami płuc ograniczonymi tylko do jednego płata bez stwierdzonej przedoperacyjnie choroby węzłowej, poddanych planowej lobektomii. Pacjenci byli wykluczani, jeśli operacja wymagała resekcji klinowej, biopsji płuca lub resekcji torakoskopowych. Czterech chirurgów klatki piersiowej przeprowadziło resekcje przy użyciu standardowych technik dysekcji i staplerów. U wszystkich pacjentów zastosowano śród- i pooperacyjne znieczulenie zewnątrzoponowe klatki piersiowej (TEDA). Obecność rozedmy płuc i zrostów opłucnowych nie była powodem wykluczenia pacjentów.
Pod koniec operacji i przed zamknięciem klatki piersiowej płuco było wentylowane pod dodatnim ciśnieniem końcowo-wydechowym, a do jamy klatki piersiowej wprowadzono ciepłą sól fizjologiczną w celu sprawdzenia, czy nie ma przecieków powietrza. Następnie chirurg korygował wszelkie nieszczelności chirurgicznie. Pacjenci zostali następnie przydzieleni do grupy kontrolnej lub grupy Vivostat (20 pacjentów na grupę) na podstawie kodów randomizacyjnych wygenerowanych losowo przez komputer i dostarczonych w zapieczętowanych kopertach. Pacjenci przydzieleni do grupy kontrolnej nie byli poddawani żadnym dodatkowym interwencjom. Od pacjentów przydzielonych do grupy Vivostat pobrano 120 ml krwi i przygotowano dla nich uszczelniacz fibrynowy Vivostat® zgodnie z instrukcjami producenta. Vivostat® zastosowano na wszystkich obszarach ryzyka przecieków powietrza i krwawienia (wszystkie obszary dysekcji) przy opróżnionym płucu i bez wentylacji. Po 5 minutach przywrócono wentylację płuca, a klatkę piersiową zamknięto, pozostawiając dwa dreny ustawione na 10-15 cm H2O.
Następujące zmienne były mierzone i rejestrowane codziennie do momentu wypisania ze szpitala: współczynnik przecieku powietrza w dniu operacji, a następnie codziennie rano do momentu usunięcia drenów z klatki piersiowej; czas do usunięcia drenu z klatki piersiowej; 24-godzinna objętość drenażu z drenu z klatki piersiowej (krwawienie/wydzielina) po usunięciu drenu z klatki piersiowej, czas trwania leczenia TEDA i pooperacyjny czas pobytu w szpitalu. Rejestrowano również pooperacyjny poziom hemoglobiny i leukocytów. Współczynnik przecieku powietrza oceniano za pomocą mechanicznej pompy ssącej i wyrażano w litrach na minutę. Personel rejestrujący te parametry nie znał przynależności pacjentów do grup badawczych. Zdarzenia niepożądane były monitorowane podczas całego pobytu pacjentów w szpitalu. Pooperacyjny przeciek powietrza, drenaż klatki piersiowej i czas hospitalizacji zostały wykorzystane jako wskaźniki chorobowości pooperacyjnej.
- Analiza statystyczna
Dane dla każdej zmiennej i w każdej randomizowanej grupie przetestowano pod kątem istotnych odchyleń od rozkładu normalnego przy użyciu testu Kołmogorowa-Smirnowa. Testy dwustronne (dane o rozkładzie normalnym) lub test U Manna-Whitneya (dane o rozkładzie innym niż normalny) zostały wykorzystane do oceny istotności różnic między średnimi lub medianami grup, w zależności od potrzeby. Istotność wszelkich proporcjonalnych różnic w atrybutach (np. z przeciekiem powietrza lub bez przecieku) oceniano za pomocą dokładnego testu Fishera (obie grupy). Analizę statystyczną przeprowadzono przy użyciu oprogramowania SPSS, wersja 12.0.1 (SPSS Inc., USA).
- Wyniki
4.1. Charakterystyka pacjentów
Obie grupy były podobne pod względem cech demograficznych i wyjściowych (Tabela 1). Średni wiek całej badanej populacji wynosił 64 lata (odchylenie standardowe 11), a 29 pacjentów (72,5%) było palaczami. Istniało prawdopodobieństwo różnicy w odniesieniu do ich wymuszonego przepływu wydechowego w 1s (FEV1); jednak analiza danych poszczególnych pacjentów nie wykazała widocznego związku między wyjściowymi wartościami FEV1 a którąkolwiek ze zmiennych wydajności. Ogólny stan pacjentów uznano za kwalifikujący do lobektomii. W grupie kontrolnej znalazł się 1 pacjent z rozedmą płuc i jeden ze zrostami opłucnowymi. W grupie Vivostat 1 pacjent wymagał dekortykacji w celu uwolnienia miąższu płucnego objętego niedodmą, a u innego występowały zrosty połączone z rozedmą płuc. Żaden z pacjentów w tym badaniu nie został poddany dodatkowej bullektomii, ponieważ zmiany rozedmowe były uogólnione z minimalnym tworzeniem się pęcherzy.
Tabela 1: Wyjściowe dane demograficzne
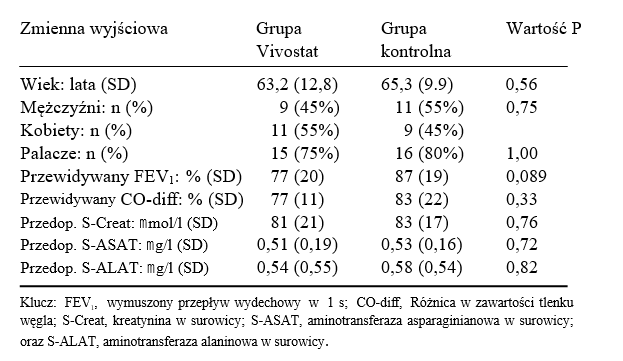
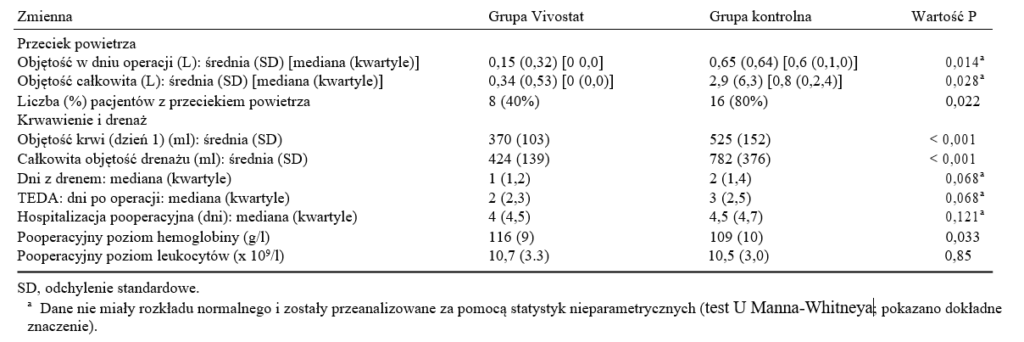
Tabela 2: Zmienne dotyczące chorobowości pooperacyjnej
4.2. Wycofywanie pacjentów i działania niepożądane
Żaden pacjent nie został wycofany z badania i nie odnotowano żadnych działań niepożądanych podczas badania. Po operacji pacjenci z grupy kontrolnej mieli znacząco niższe stężenie hemoglobiny niż pacjenci z grupy Vivostat. Pooperacyjne poziomy leukocytów były podobne w obu grupach.
4.3. Zmienne dotyczące wydajności
Wyniki dla każdej ze zmiennych wydajności dla obu randomizowanych grup podsumowano w tabeli 2. Stosowanie Vivostatu wiązało się ze średnio o 255 ml mniejszą objętością drenażu w 24-godzinnym okresie pooperacyjnym i średnio o 382 ml mniejszą całkowitą objętością drenażu w porównaniu z grupą kontrolną. Różnice te były wysoce istotne statystycznie (w obu przypadkach P ˂ 0,001).
Liczba pacjentów bez przecieku powietrza bezpośrednio po operacji (dzień 0) była istotnie większa (16 pacjentów, 80%) w grupie Vivostat w porównaniu z grupą kontrolną (8 pacjentów, 40%) (P = 0,02). Spośród pacjentów, u których nie odnotowano przecieku powietrza w dniu operacji, czterech w grupie Vivostat i jeden w grupie kontrolnej miało przecieki powietrza zarejestrowane w pierwszej dobie pooperacyjnej. Odsetek pacjentów bez przecieku powietrza w dowolnym dniu wynosił 12 w grupie Vivostat i 7 w grupie kontrolnej (60 vs. 35%, P = 0,21) (ryc. 1). Mediana szybkości przecieku powietrza była znacząco niższa w grupie Vivostat w porównaniu z grupą kontrolną w dniu operacji (różnice median wyniosły 0,5 l/min; P = 0,01) i uśredniła się w okresie drenażu klatki piersiowej (różnice median wyniosły 0,6 l/min). Chociaż mediany czasu trwania drenażu klatki piersiowej i hospitalizacji były mniejsze w grupie Vivostat w porównaniu z grupą kontrolną (odpowiednio 1 i 0,5 dnia), różnice te nie były istotne statystycznie. W grupie Vivostat rzadziej występowała potrzeba pooperacyjnego TEDA, choć różnica nie była istotna (mediany: 2 vs. 3 dni, P = 0,07).
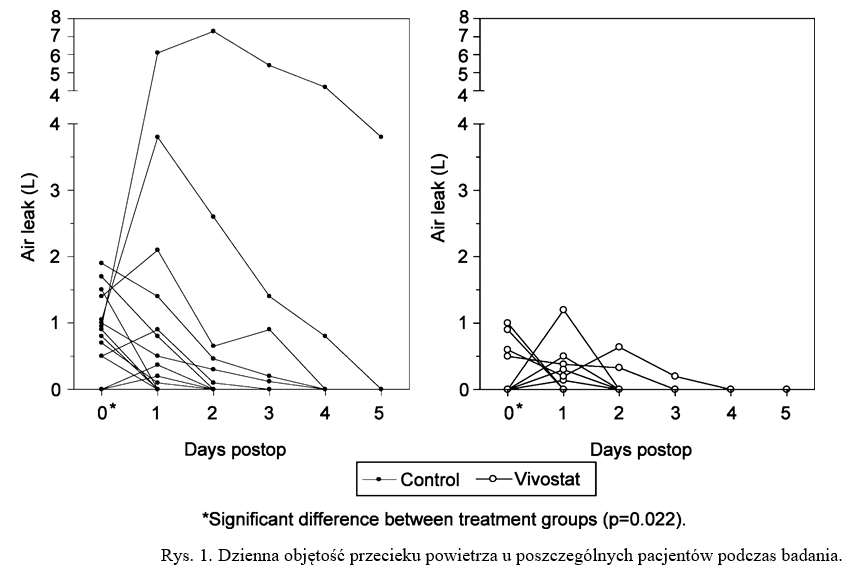
- Dyskusja
Chirurgia płuc często obejmuje różne stopnie ich resekcji, a czasami dekortykację, co prowadzi do krwotoków i przecieków powietrza. Skrupulatna dbałość o hemostazę podczas operacji może zmniejszyć utratę krwi, ale skuteczne techniki zmniejszania przecieków powietrza wciąż wymagają udoskonalenia. W tym celu dostępne są różne materiały naturalne i syntetyczne, w tym uszczelniacze fibrynowe, włóknina kolagenowa, klej syntetyczny i szwy mechaniczne (stosowanie staplerów).
Wykazano, że stosowanie uszczelniaczy fibrynowych zmniejsza powikłania przecieku powietrza, takie jak przetoki oskrzelowo-opłucnowe, tworzenie się zrostów opłucnowych, odma opłucnowa i infekcje wtórne. Konwencjonalne uszczelniacze fibrynowe wykorzystują składniki przygotowane z połączonego ludzkiego osocza (fibrynogen, trombina), a czasami składniki pochodzenia zwierzęcego (np. bydlęca aprotynina lub trombina). Wiąże się z nimi potencjalne ryzyko przenoszenia materiałów zakaźnych pochodzenia ludzkiego lub zwierzęcego (np. wirusów, takich jak wirus zapalenia wątroby typu B lub C, wirus ludzkiej białaczki z komórek T, ludzkiego wirusa niedoboru odporności typu 1 (HIV-1) lub prionów odpowiedzialnych za choroby, takie jak choroba Creutzfeldta-Jakoba (CJD) lub gąbczasta encefalopatia bydła (BSE)). Istnieją dodatkowe obawy dotyczące reakcji antygenowych na obce białka i obawy związane z zakrzepami spowodowanymi wysokimi stężeniami dodanej trombiny. Autologiczny uszczelniacz fibrynowy wolny od dodanej trombiny, taki jak Vivostat, zapewnia określone środki zapobiegania tym potencjalnym działaniom niepożądanym.
W niniejszym badaniu wykazano, że wspomagające stosowanie autologicznego uszczelniacza fibrynowego Vivostat® podczas lobektomii znacząco zmniejsza pooperacyjny przeciek powietrza, zarówno pod względem jego wielkości u poszczególnych pacjentów, jak i pod względem odsetka pacjentów doświadczających przecieku powietrza. Mniejsze jest również krwawienie / wysięk pooperacyjny. Większość płynu drenażowego, przynajmniej w ciągu pierwszych 24 godzin, jest spowodowana krwawieniem. Zastosowanie Vivostatu zmniejszyło tę objętość w ciągu pierwszych 24 godzin o 155 ml i o 358 ml ogółem, z nadwyżką kompensując 120 ml krwi oddanej przez pacjenta w celu przygotowania uszczelniacza fibrynowego. Nieznacznie wyższy poziom hemoglobiny odnotowano w grupie Vivostat po operacji, chociaż nie udało się potwierdzić, że było to bezpośrednią konsekwencją zmniejszonej utraty krwi uzyskanej dzięki Vivostat. Oczekuje się, że zmniejszenie krwawienia i przecieku powietrza zmniejszy potrzebę drenażu klatki piersiowej i ograniczy czas hospitalizacji. Chociaż wyniki dla tych parametrów były korzystne dla Vivostatu, nie stwierdzono różnic istotnych statystycznie. Skrócenie czasu hospitalizacji wiąże się ze znacznymi korzyściami kosztowymi, dlatego uzasadnione może być przeprowadzenie większego badania w celu ustalenia, czy uszczelniacz fibrynowy Vivostat® przynosi znaczące korzyści w tym zakresie.
Rezultaty wcześniejszych badań wpływu uszczelniaczy fibrynowych na wyniki operacji płuc nie pozwoliły na spójne wnioski w odniesieniu do przecieków powietrza i czasu drenażu klatki piersiowej. Wong i Goldstraw, w randomizowanym badaniu 66 pacjentów z przeciekami powietrza pęcherzykowego po operacji płuc, zidentyfikowali nieistotnie krótszy, ale zredukowany czas drenażu klatki piersiowej (6 vs. 9 dni) i hospitalizacji (6 vs. 8 dni) odpowiednio dla uszczelniacza fibrynowego (natryskiwanego) i nieleczonych grup kontrolnych. Fleischer i wsp. również nie byli w stanie zidentyfikować istotnego wpływu uszczelniacza fibrynowego na skrócenie czasu drenażu klatki piersiowej (6,0 vs. 5,9 dnia) i hospitalizacji (9,8 vs. 11,5) lub czasu trwania przecieku powietrza (2,3 vs. 3,3 dnia), odpowiednio dla uszczelniacza fibrynowego w porównaniu z grupą kontrolną, w badaniu obejmującym 28 pacjentów poddanych lobektomii. Gagarine i wsp., w retrospektywnym badaniu 360 pacjentów, z których 102 otrzymało uszczelniacz fibrynowy podczas operacji, zidentyfikowali istotne skrócenie o 1,4 dnia czasu trwania drenażu klatki piersiowej za pomocą uszczelniacza fibrynowego w porównaniu z grupą kontrolną, ale nie stwierdzili żadnej istotnej różnicy w odsetku pacjentów z przedłużonymi przeciekami powietrza (˃7 dni) lub w długości pobytu w szpitalu (odpowiednio 6,3 vs. 7,7 dnia). Wreszcie, w badaniu kliniczno-kontrolnym obejmującym 100 pacjentów poddawanych precyzyjnym resekcjom z powodu przerzutów nowotworowych do płuc stwierdzono większe korzyści ze stosowania uszczelniacza fibrynowego w porównaniu z kauteryzacją. Korzyści te dotyczyły czasu trwania przecieku powietrza (2,7 vs. 7,8 dnia, P˂0,001), czasu trwania drenażu (4,5 vs. 9,5, P˂0,001) i pobytu w szpitalu (6,5 vs. 11,5 dnia, P˂0,001). W przypadku kauteryzacji wystąpiło więcej działań niepożądanych (28% vs. 2%, P˂0,001). W powyższych badaniach czas hospitalizacji (mediana 4,5 dnia) i czas trwania drenażu (mediana 2 dni) w grupach kontrolnych były znacząco dłuższe niż w naszym badaniu (mediana 4,5 dnia); co sugeruje różnice w pooperacyjnym prowadzeniu pacjentów. Stosunkowo krótki okres hospitalizacji w naszym badaniu zmniejsza prawdopodobieństwo znalezienia istotnej różnicy między grupami terapeutycznymi.
Według naszej wiedzy przeprowadzone przez nas badanie było pierwszym randomizowanym badaniem klinicznym, w którym mierzono przeciek powietrza śródoperacyjnie, gdy pacjenci byli jeszcze podłączeni do respiratora, a następnie pooperacyjnie za pomocą przepływomierza w mechanicznym elektrycznym urządzeniu ssącym, z pomiarami powtarzanymi aż do usunięcia drenażu klatki piersiowej. Umożliwiło to ilościowe określenie przecieku powietrza, a także płynu drenażowego z drenu w klatce piersiowej. W ten sposób, pomimo stosunkowo małych grup (20 osób na grupę), byliśmy w stanie wykazać znaczącą przewagę leczenia w grupie z Vivostatem nad grupą kontrolną pod względem zachorowalności pooperacyjnej.
Od pewnego czasu rutynowo stosujemy Vivostat w kardiochirurgii do reoperacji, rozwarstwień aorty i innych krwawień wysokiego ryzyka, a także stosujemy Vivostat okołooperacyjnie u pacjentów poddawanych zabiegom torakoskopowym, w celu kontroli przecieków powietrza i krwawień. Korzyści w zakresie zachorowalności wykazane dla Vivostatu w tym randomizowanym, zaślepionym badaniu stanowią dobre uzasadnienie dla jego rutynowego stosowania jako uszczelniacza tkankowego do lobektomii płucnych.
Źródło badań: Badania udostępnione przez Vivostat®
Do jakich zabiegów wykorzystać poszczególne roztwory fibryny bogatopłytkowej? Poznaj ich rodzaje
- Vivostat® Fibrin
Matryca fibrynowa przeznaczona do różnych zabiegów chirurgicznych o właściwościach uszczelniających, klejących i hemostatycznych z natychmiastową polimeryzacją, wysoką elastycznością i silnymi właściwościami adhezyjnymi. Jako autologiczny klej wykazuje biokompatybilność i eliminuje ryzyko zakażenia wirusowego pochodzącego z produktów opartych na krwi pojedynczego dawcy, krwi mieszanej lub składników bydlęcych. Jest to jedyny sposób na zagwarantowanie pacjentowi ochrony przed chorobami wirusowymi, które mogą jeszcze nie być zidentyfikowane.
- Vivostat® PRF
Produkt o wysokim stężeniu nieaktywowanych płytek krwi o zaawansowanych właściwościach uszczelniających, gojących i regeneracyjnych. Połączenie matrycy fibrynowej i koncentratu płytek krwi generuje nośnik i kontrolowane uwalnianie czynników wzrostu. Płytki krwi i czynniki wzrostu są stosowane od wielu lat w celu wspomagania regeneracji tkanek i stymulacji tworzenia kości, zazwyczaj jako tradycyjny roztwór trombocytów dostarczany przez bank krwi. Vivostat® PRF zawiera różnorodne, silnie działające czynniki wzrostu, które stymulują proliferację fibroblastów i syntezę tkanek, m.in. TGF-β1, PDGF, VEGF, FGF-2.
- Obsidian® ASG
Autologiczny, bioaktywny uszczelniacz bogatopłytkowy do wzmacniania i ochrony zespoleń po operacjach resekcji przewodu pokarmowego. Jest przeznaczony do skutecznego uszczelniania i gojenia zespoleń i wiąże się z niskim wskaźnikiem nieszczelności zespoleń. Produkt nie tylko uszczelnia i wspomaga gojenie zespoleń, ale również wykorzystuje naturalne zdolności regeneracyjne organizmu, aby przyspieszyć i wspomóc proces zdrowienia, poprawiając tym samym ogólny przebieg rekonwalescencji.
- Obsidian® RFT
Jest przeznaczony do zamykania i leczenia przetok i może być podawany razem z antybiotykami osadzonymi w Obsidian® RFT. Produkt jest autologiczną, bioaktywną macierzą o wysokiej zawartości płytek krwi, które uwalniają nieaktywowane płytki w sposób wydłużony – po kontakcie z tkanką płytki te uwalniają czynniki wzrostu przez okres 5-7 dni, wspomagając regenerację tkanek i gojenie przetok. Specjalna szczoteczka do przetok, dołączona do zestawu, ułatwia przygotowanie kanału przetoki przed aplikacją.
- ArthoZheal®
Bogatopłytkowa matryca fibryna do chirurgii artroskopowej o właściwościach bioaktywnych i biokompatybilnych, oferująca synergistyczne działanie w zakresie uszczelniania, gojenia i regeneracji więzadeł, ścięgien i chrząstki. ArthroZheal® może być stosowany razem z komórkami macierzystymi, BMAC, chondrocytami lub antybiotykami przy użyciu systemu Vivostat® Co-Delivery.
Dzięki ArthroZheal® całościowe doświadczenie zabiegów ortopedycznych zmienia się zarówno dla pacjentów, jak i chirurgów. Jego bioaktywne i biokompatybilne właściwości wspomagają uszczelnianie, gojenie i regenerację więzadeł, ścięgien i chrząstki. Wywołuje natychmiastową polimeryzację i doskonałą adhezję, pozostając na miejscu aplikacji, nawet na pionowych i wilgotnych powierzchniach. Dodatkowo poprawia kontrolę krwawienia, działa przeciwzapalnie i przeciwdrobnoustrojowo, pomagając kontrolować potencjalne zakażenie
Jeśli masz pytania dotyczące Vivostat®, skonsultuj się z naszą specjalistką.

Brand Manager – Wydział Aparatury Medycznej.
Sprawdź czy zainteresują Cię podobne wpisy:
Czy jesteś specjalistą w dziedzinie chirurgii?
Zapisz się na nasz newsletter, abyśmy mogli Ci przesyłać informacje i aktualności w zakresie chirurgii, w tym informacje o nowych artykułach, webinarach, szkoleniach czy wydarzeniach branżowych.