- Proszę czekać...
Gloreha (rękawica do rehabilitacji ręki): podsumowanie wyników badań klinicznych

Stół do masażu Terapeuta 7 sekcyjny z Pivotem
09.02.2015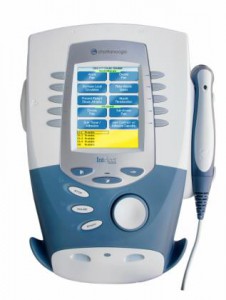
Aparat do terapii ultradźwiękowej i terapii kombinowanej Intelect Advanced
17.02.2015Gloreha (rękawica do rehabilitacji ręki): podsumowanie wyników badań klinicznych
czerwiec 2014 – przegląd B
Chociaż Gloreha jest nowym urządzeniem, jego skuteczność została już zweryfikowana w kilku badaniach klinicznych, które objęły następujące grupy pacjentów:
- pacjenci po udarze mózgu, w fazie podostrej (do 90 dni po udarze; MAS ≤ 3) 1,2,3,4;
- pacjenci po udarze mózgu, w fazie chronicznej (przynajmniej 6 miesięcy po udarze; MAS < 3) 5,6;
- pacjenci po udarze mózgu leczeni toksyną botulinową 7,2;
- pacjenci po udarze mózgu, z zespołem zaniedbywania połowiczego (uszkodzenie prawej półkuli mózgu w wyniku pierwszego udaru niedokrwiennego; MAS < 3) 8,9,2;
- pacjenci z niedowładem połowiczym po neuro-onkologicznych zabiegach chirurgicznych (deficyt funkcji ręki; MAS ≤ 3) 10;
- inni pacjenci neurologiczni: pacjenci z urazowym uszkodzeniem mózgu, oponiakiem rdzenia kręgowego 2.
Poniżej przedstawiono główne wnioski na podstawie badań klinicznych Gloreha:
- Gloreha może zwiększyć siłę chwytu (chwyt globalny, kluczowy, trójpalcowy i przeciwstawny) po porażonej stronie pacjentów neurologicznych w fazie podostrej.
Vanoglio i wsp., 2013. Grupa pacjentów leczona przy pomocy Gloreha osiągnęła większy przyrost siły chwytu (chwyt globalny, kluczowy, trójpalcowy i przeciwstawny) w porównaniu z grupą kontrolną. Leczenie składało się z 30 sesji, każda po 40 min. Terapia pacjentów z grupy kontrolnej prowadzona przez terapeutów miała ten sam wymiar czasowy.
- Gloreha może poprawić niezależność funkcjonalną pacjentów neurologicznych, zwłaszcza w fazie podostrej.
Vanoglio i wsp., 2013. Randomizowane, kontrolowane badanie kliniczne przeprowadzono na grupie 10 pacjentów po udarze mózgu, w fazie podostrej. W grupie leczonej przy pomocy Gloreha odnotowano znaczącą poprawę, której oceny dokonano na podstawie Skali Oceny Samodzielności Funkcjonalnej (FIM). W grupie kontrolnej nie odnotowano istotnych zmian. Leczenie składało się z 30 sesji, każda po 40 min. Terapia pacjentów z grupy kontrolnej prowadzona przez terapeutów miała ten sam wymiar czasowy. IRCCS Maugeri Foundation in Lumezzane oraz Habilita Clinic in Sarnico we Włoszech stosują ten sam protokół wobec kolejnych pacjentów w celu uzyskania większej próby badanej i lepiej udokumentowanych wyników badań.
Springhetti i wsp., 2014. Badanie kliniczne obejmuje pacjentów z niedowładem połowiczym po zabiegach neuro-onkologicznych. Leczenie przy pomocy Gloreha składa się z 20 sesji po 45 min każda. Poniższy wykres przedstawia wstępne wyniki: urządzenie Gloreha pomogło pacjentom zwiększyć niezależność funkcjonalną ocenianą według skali FIM. Badanie kliniczne nie zostało jeszcze zakończone; Dr Springhetti zaprezentuje końcowe wyniki w czasie 42nd National Congress of Italian Society of Medicine and Physical Rehabilitation w Turynie we Włoszech w październiku przyszłego roku.
Parrinello i wsp., 2013. Leczenie z zastosowaniem Gloreha obejmowało 10 codziennych sesji po 30 min każda; rozpoczęcie leczenia po co najmniej 3 tygodniach od incydentu neurologicznego. Poprawę niezależności funkcjonalnej ocenianej według skali FIM odnotowano u wszystkich 12 pacjentów objętych badaniem.
- Leczenie z zastosowaniem Gloreha może poprawić sprawność manualną i koordynację jednej lub obu rąk u pacjentów neurologicznych, zwłaszcza w fazie podostrej.
Vanoglio i wsp. 2013. Uśredniona poprawa sprawności manualnej i koordynacji jednej ręki (paretyczna i zdrowa kończyna) i obu rąk obliczanej jako t1 – t0 (t1: po leczeniu; t0: przed leczeniem) jest wyższa w grupie leczonej z zastosowaniem Gloreha niż w grupie kontrolnej. W badaniu wzięli udział pacjenci po udarze mózgu, w fazie podostrej. W obu grupach pacjentów leczenie składało się z 30 sesji, każda po 40 min.
Veralta i wsp., 2013. W czasie badania po 4 miesiącach od udaru krwotocznego a przed rozpoczęciem leczenia pacjent F. M. wykazywał duże trudności w posługiwaniu się lewą ręką przy wykonywaniu ćwiczeń wymagających znacznej sprawności manualnej. Po leczeniu z zastosowaniem Gloreha u tego pacjenta odnotowano poprawę w obu testach (Purdue PegBoard Test oraz Nine Hole Peg Test). Leczenie składało się z 10 sesji rehabilitacyjnych po 25 min każda.
Springhetti I wsp., 2014. Badanie kliniczne przeprowadzane jest na grupie pacjentów z niedowładem połowiczym, po zabiegach neuro-onkologicznych. Leczenie przy użyciu Gloreha składa się z 20 sesji po 45 min każda. Oburęczna sprawność manualna jest oceniana w teście Box and Block. Wykres poniżej przedstawia wstępne wyniki. Są one pozytywne, jednakże badanie nie zostało jeszcze zakończone.
- Gloreha może poprawić ruchliwość (ruchy czynne) pacjentów neurologicznych.
Springhetti i wsp., 2014. Badanie kliniczne przeprowadzane jest na grupie pacjentów z niedowładem połowiczym, po zabiegach neuro-onkologicznych. Leczenie przy użyciu Gloreha składa się z 20 sesji, po 45 min każda. Oburęczna sprawność manualna jest oceniana w teście Box and Block. Wykres poniżej przedstawia wstępne wyniki w odniesieniu do wskaźnika ruchliwości (MI). Są one pozytywne, jednakże badanie nie zostało jeszcze zakończone.
Vanoglio i wsp., 2013. U pacjentów leczonych przy pomocy Gloreha wykazano większy wzrost ruchliwości mierzony przy pomocy wskaźnika ruchliwości (Motricity Index), zarówno po stronie paretycznej i jak i po stronie zdrowej, niż u pacjentów w grupie kontrolnej. Leczenie składało się z 30 sesji po 40 min każda, zarówno w grupie leczonej przy pomocy Gloreha, jak i w grupie kontrolnej leczonej przez terapeutów.
- Gloreha może zmniejszyć hipertonię lub jej zapobiec u pacjentów neurologicznych.
Bissolotti i wsp., 2014. Badanie kliniczne przeprowadzono na 11 pacjentach po udarze mózgu, w fazie chronicznej (przerwa między incydentem i włączeniem pacjenta: 96,3 +/-125,1 miesiąca). Leczenie z zastosowaniem Gloreha składało się z 10 sesji, każda po 30 min. Odnotowano znaczące korzyści kliniczne w postaci obniżenia napięcia spoczynkowego mięśni. Wykres poniżej przedstawia wyniki uzyskane w chwili T0 (przed pierwszą sesją terapeutyczną z zastosowaniem Gloreha), T1 (po pierwszej sesji terapeutycznej z zastosowaniem Gloreha), T2 (przed ostatnią sesją terapeutyczną z zastosowaniem Gloreha) oraz T3 (po ostatniej sesji terapeutycznej z zastosowaniem Gloreha).
Stagno i wsp., 2013. 8 pacjentów po udarze mózgu, w fazie chronicznej, wykazało zmniejszenie spastyczności po upływie 1 tygodnia, a następnie po upływie 1 miesiąca od iniekcji BoNT-A (toksyna botulinowa typu A) i rozpoczęcia leczenia z zastosowaniem Gloreha.
supalta i wsp., 2013. Pacjent B.M. po udarze mózgu, w fazie chronicznej (35 miesięcy po incydencie), wykazał mniejszy poziom spastyczności palców po leczeniu z Gloreha (od MAS=2 do MAS=1). Leczenie składało się z 10 sesji, każda po 25 min.
Vanoglio i wsp., 2013. Napięcie spoczynkowe mięśni u pacjentów leczonych z zastosowaniem Gloreha nie rozwinęło się w spastyczność lub, jak miało to miejsce w kilku przypadkach, odnotowano niewielki wzrost spastyczności. Badanie kliniczne przeprowadzono na pacjentach po udarze mózgu, w fazie podostrej. Terapia trwała 30 dni, po 40 min każdego dnia.
- Gloreha może redukować obrzęk u pacjentów neurologicznych.
Lombardi i wsp., 2014. Badanie kliniczne jest prowadzone na grupie pacjentów z niedowładem połowiczym po udarze mózgu. Jest to badanie randomizowane, z próbą krzyżową. Leczenie z zastosowaniem Gloreha trwa przez 5 kolejnych dni, każda sesja po 42 min. Wykres poniżej przedstawia zmiany obrzęku u 9 pacjentów w czasie pierwszego “tygodnia kontrolnego” (Gloreha 0) i pierwszego „tygodnia terapii” (Gloreha1). Badanie to jest w toku.
Vanoglio i wsp., 2013. U wszystkich pacjentów objętych badaniem, zarówno leczonych przy pomocy Gloreha jak i u tych, którzy leczeni byli przez terapeutów, zaobserwowano zmniejszenie obrzęku. Badanie kliniczne przeprowadzono na grupie pacjentów po udarze mózgu, w fazie podostrej. Pacjentów poddano terapii w sesjach po 40 min przez 30 dni.
Molteni i wsp., 2011. Po leczeniu z zastosowaniem prototypu Gloreha u 5 spośród 7 pacjentów uzyskano zmniejszenie obrzęku.
- Gloreha może poprawić pulsację naczyniową zginaczy porażonej kończyny górnej u pacjentów po udarze mózgu.
Bissolotti i wsp., 2014. Badanie kliniczne przeprowadzono na grupie 11 pacjentów po udarze mózgu, w fazie chronicznej (okres od incydentu do włączenia do badania 96,3 +/- 125,1 miesięcy). Sesja terapeutyczna z Gloreha trwała 20 min. Dzięki spektroskopii w bliskiej podczerwieni (NIRS) oceniono korzyści kliniczne ze stosowania urządzenia Gloreha w zakresie zwiększonego lokalnego przepływu krwi, poprawy sprężystości i proliferacji naczyń włosowatych oraz poprawy gęstości komórkowej wokół włókien. Szczególnie ważną częścią badania była ocena znaczących zmian THB (THB – hemoglobina całkowita). Suma zmian THB wyniosła 19,32 +/- 8,20 (5,21 +/- 1,78% w porównaniu z wartością wyjściową).
- Gloreha może zmniejszyć uczucie ciężkości, sztywności i bólu kończyny górnej.
Bissolotti i wsp., 2014. Badanie kliniczne przeprowadzono na 11 pacjentach po udarze mózgu, w fazie chronicznej (okres od incydentu do włączenia do badania 96,3 +/- 125,1 miesięcy). Leczenie z zastosowaniem Gloreha składało się z 10 codziennych sesji, każda po 30 min. Odnotowano znaczące korzyści kliniczne w zakresie postrzegania objawów przez pacjentów. Wykres poniżej przedstawia wyniki uzyskane w T0 (przed pierwszą sesją z Gloreha), T1 (po pierwszej sesji terapeutycznej z Gloreha) oraz T3 (po ostatniej sesji terapeutycznej z Gloreha). Odczuwanie ciężkości nadgarstka i palców zmniejszyło się od 34,5 +/- 31,2 w T0 do 19,5 +/- 19,2 w T1; odczuwanie sztywności nadgarstka i palców zmniejszyło się od 43,6 +/- 23,7 do 25,5 +/- 19,6. (wykres) Zmiany odczuwania ciężkości nadgarstka i palców.
- Gloreha może poprawić eksplorację i uwagę wzrokowo-przestrzenną u pacjentów z zespołem zaniedbywania połowiczego po udarze mózgu.
supalta i wsp., 2014. Leczeniu z zastosowaniem Gloreha poddano trzech praworęcznych pacjentów z uszkodzeniem prawej półkuli mózgu po pierwszym udarze niedokrwiennym. Każdy z pacjentów został poddany programowi treningowemu składającemu się z 10 sesji po 30 min. Urządzenie Gloreha zostało użyte do przeprowadzenia zrobotyzowanego treningu lewej ręki. W teście Line Crossing (przyp. tłum. rodzaj testu wykreślania) odnotowano średnią zmianę 58,7% całościowej oceny w punkcie końcowym, przy czym średnia poprawa wyniku po stronie lewej wyniosła 98,9% (w teście Line Crossing bada się zdolność pacjenta do wyszukiwania wzrokowego określonych znaków wśród innych znaków rozrzuconych w obszarze zaniedbywanej połowy przestrzeni i zaznaczania ich w określony sposób).
W teście Bells (przyp. tłum. wyszukiwanie dzwonków wśród różnych figur i zaznaczanie ich) odnotowano średnią zmianę 13,2% całościowej oceny w punkcie końcowym, przy czym średnia poprawa wyniku po stronie lewej wyniosła 53,9% (test Bells pozwala na jakościową i ilościową ocenę zaniedbywania połowiczego w bliskiej przestrzeni pozaosobowej).
W teście Sentence Reading odnotowano średnią zmianę 300% całościowej oceny w punkcie końcowym (test Sentence Reading sprawdza zdolność czytania zdań napisanych od strony lewej do prawej).
U pacjentów poddanych Saccadic Training odnotowano średnie zmniejszenie czasu reakcji o 29,3% na bodźce z lewej strony, z redukcją asymetrii o 42,8% (Saccadic Training – jeden z testów dostępnych dzięki oprogramowaniu RehaCom, którego użyto do oceny czasu reakcji na bodźce ze strony lewej oraz ze strony prawej).
W zadaniu na ciągłość uwagi (Sustained Attention to Response Task) odnotowano zmniejszenie pominięć o 12,1% w ocenie końcowej (zadanie na ciągłość uwagi jest testem sprawdzającym czas reakcji, wymagającym ciągłości uwagi i kontroli poznawczej. Oceniana jest zdolność podtrzymania uwagi w warunkach występowania elementu powstrzymującego odpowiedź).
- Rękawica Gloreha jest dobrze tolerowana przez pacjentów: wszystkie testy wykazują wysoki poziom stosowania się pacjentów do zaleceń.
- Gloreha może wydłużyć czas terapii, przy ograniczonych kosztach: Gloreha może przynieść znaczące korzyści ekonomiczne i umożliwić realokację personelu / terapeutów.
Vanoglio i wsp., 2013. Koszt tradycyjnego leczenia prowadzonego przez terapeutów przewyższał koszt leczenia przy pomocy Gloreha (uwzględniono czas potrzebny terapeucie na zastosowanie urządzenia, nie uwzględniono kosztu urządzenia). Leczenia składało się z 30 sesji rehabilitacyjnych, po 40 min na każdą sesję.
Koszt na pacjenta
Badanie Vanoglio i wsp., 2013, wykazało, że terapia przy pomocy rękawicy Gloreha nie ustępuje terapii standardowej. W rzeczywistości grupa leczona przy pomocy Gloreha wykazała więcej znaczących korzyści klinicznych w porównaniu z grupą kontrolną ale potrzebne są dalsze badania dla potwierdzenia dotychczasowych wniosków. Trwają dalsze badania, których celem jest ugruntowanie rezultatów wymienionych powyżej i rozszerzenie wniosków dzięki większej próbie badawczej oraz sprawdzeniu przydatności Gloreha w leczeniu innych schorzeń, jak na przykład uraz rdzenia kręgowego lub pourazowe uszkodzenie mózgu. Prowadzone są szczegółowe badania, których celem jest:
- zmierzyć plastyczność mózgu pobudzaną przez urządzenie Gloreha, dzięki ilościowej analizie EEG 11;
- zmierzyć efektywność „terapii przez działanie i obserwowanie” (Action Observation Therapy) prowadzonej przy pomocy Gloreha (wieloośrodkowe badanie kliniczne) 12;
- zmierzyć korzyści kliniczne terapii w warunkach domowych z zastosowaniem Gloreha Lite (wieloośrodkowe badanie kliniczne) 13.
Urządzenie Gloreha zostało opracowane według koncepcji zgodnej z wnioskami płynącymi z najnowszej literatury naukowej:
- leczenie rehabilitacyjne po udarze mózgu musi być intensywne, powtarzalne, funkcjonalne, zorientowane na określone zadanie, precyzyjnie określone, dostosowywane do indywidualnych potrzeb 14,15;
- urządzenia biomechatroniczne, systemy robotyczne i interfejsy komputerowe mogą ułatwiać odzyskiwanie sprawności funkcjonalnej i zmniejszać upośledzenie motoryki kończyny górnej 16,17,18,19;
- program terapeutyczny oparty na powtórzeniach zginania i prostowania palców może poprawić funkcjonowanie ręki porażonej po udarze mózgu; program taki może zmniejszyć obrzęk, podtrzymać lub zwiększyć zakres ruchów i długość mięśni oraz zapobiec spastyczności 20,21,22,23,24;
- bierne rozciąganie może zapobiec akumulacji tkanki łącznej w mięśniu i wspomagać naukę ruchu 26,27,28;
- ćwiczenia z zastosowaniem urządzeń do rehabilitacji wpływają na plastyczność centralnego układu nerwowego dzięki feedbackowi neuromotorycznemu, wizualnemu i dźwiękowemu: oddziałujące na kilka zmysłów systemy służące obserwowaniu i wykonywaniu ćwiczeń umożliwiają pacjentom ponowne uczenie się upośledzonych funkcji motorycznych poprzez aktywację wewnętrznych układów związanych z wykonywaniem ruchów 29,30.
- wizualizacja motoryczna, ruchy bierne, obserwowanie ruchu, ćwiczenia ręki w rzeczywistości wirtualnej (VR) mogą aktywować czuciowo-ruchowe obszary mozgu 31,32,33,34,35.
Stosowanie urządzenia Gloreha jest zgodne z najbardziej zaawansowanymi terapiami rehabilitacyjnymi, takimi jak: wizualizacja motoryczna, terapia lustrzana, terapia ruchem wymuszonym koniecznością (TRWK), trening oburęczny.
- Vanoglio F., Luisa A., Garofali F., Mora C.; Evaluation of the effectiveness of Gloreha (Hand Rehabilitation Glove) on
hemiplegic patients. Pilot study; presented at XIII Congress of Italian Society of Neurorehabilitation, 18-20 April 2013,
Bari (Italy). - Parrinello I., Faletti S., Santus G.; Use of a continuous passive motion device for hand rehabilitation: clinical trial on
neurological patients; presented to 41° National Congress of Italian Society of Medicine and Physical Rehabilitation,
14-16 October 2013, Rome (Italy). - Lombardi F., Magnanini F., Montecchi M.G., Pederzini E., Tettamanzi S., Volta B., Meiattini E.; Evaluation of the
effectiveness of Gloreha (Hand Rehabilitation Glove) on patients treated in hospital after focal cerebral ischemia;
clinical trial in progress at S. Sebastiano Hospital, Correggio (Italy). - Molteni F., Mulè C., Caimmi M., Taveggia G., Missud S., Bianchi P.; Use of continuous passive motion device for the
hand on post-stroke patients: pilot study. Presented at 39° National Congress of Italian Society of Medicine and
Physical Rehabilitation, 16-19 October 2011, Reggio Calabria (Italy). - Bissolotti L., Robotic rehabilitation of the upper limb after stroke: analysis of peripheral vascular adaptations during
Gloreha treatment; presented at XIV Congress of Italian Society of Neurorehabilitation, 8-10 May 2014, Genova (Italy). - Bissolotti L., Symptomatic treatment with Gloreha after stroke: effects on pain and spasticity; presented at XIV
Congress of Italian Society of Neurorehabilitation, 8-10 May 2014, Genova (Italy). - Stagno D., Baricich A., Invernizzi M., Grana E., Cisari C.; Use of a robotic device in the rehabilitation treatment after
botulinum toxin (type A) injection on spastic upper limb after stroke. Pilot study; presented at XIII Congress of Italian
Society of Neurorehabilitation, 18-20 April 2013, Bari (Italy). - Varalta V., Picelli A., Fonte C., Montemezzi G., La Marchina E., Smania N.; Effects of contralesional robot-assisted
hand training in patients with unilateral spatial neglect following stroke: a case series study; under revision. - Varalta V., Smania N., Geroin C., Fonte C., Gandolfi M., Picelli A., Munari D., Ianes P., Montemezzi G., La Marchina E.;
Effects of passive rehabilitation of the upper limb with robotic device Gloreha on visual-spatial and attentive
exploration capacities of patients with stroke issues; presented at Congress “Riabilitazione: una scienza in cammino”,
18-20 March 2013, La Villa (Bolzano – Italy) and XIII Congress of Italian Society of Neurorehabilitation, 18-20 April
2013, Bari (Italy). - Springhetti I. et al.; Evaluation of the effectiveness of Gloreha (Hand Rehabilitation Glove) on hemiplegic patients.
Pilot study; clinical trial in progress at IRCCS Maugeri Foundation, Pavia (Italy). - Smania N. et al.; Assessment of dynamic EEG power changes and upper limb function after robot-assisted hand
training in stroke patients: a pilot study; clinical trial in progress at Università degli Studi di Verona (Italy). - Negrini S., Bissolotti L., Taveggia G. et al.; Evaluation of the effectiveness of the mobilization performed by the
rehabilitation glove and Action Observation Therapy on hemiplegic patients; clinical trial in progress at Don Gnocchi
Foundation, Rovato (Italy), Domus Salutis Clinic, Brescia (Italy), Habilita Hospital, Sarnico (Italy). - Scalvini S., Mulè C. et al.; Effectiveness of the hand treatment with Gloreha on hemiplegic patients as part of a tele-
rehabilitation project: a pilot study; clinical trial in progress at IRCCS Maugeri Foundation, Lumezzane (Italy), Habilita
Hospital, Sarnico (Italy). - Kollen BJ, Lindeman E. Understanding the pattern of functional recovery after stroke: Facts and theories. Restorative
Neurology and Neuroscience 2004;22:281–299 - Van Peppen RP, Kwakkel G, Wood-Dauphinee S, Hendriks HJ, Van der Wees PJ, Dekker J. The impact of physical
therapy on functional outcomes after stroke: what’s the evidence? Clin Rehabil 2004;18:833–62. - Masiero S, Celia A, Rosati G, Armeni M. Robotic-assisted rehabilitation of the upper limb after acute stroke. Arch
Phys Med Rehabil 2007;88:142-9. - Kiguchi K, Iwami K, Yasuda M, Watanabe K, Fukuda T. An exoscheleton robot for human shoulder joint motion assis.
IEEE/ASME Trans Mech 2003;8:126-36. - Hesse S, Schulte-Tigges G, Konrad M, Bardeleben A, Werner C. Robot-assisted arm trainer for the passive and active
practice of bilateral forearm and wrist movement in hemiparetic subjects. Arch Phys Med Rehab 2003;84:915-20. - Volpe B, Krebs H, Hogan N, Edelsteim L, Diels C, Aisen M. A novel approach to stroke rehabilitation: Robot aided
sensorimotor stimulation. Neurology 1999;54:1938-44. - Carey JR, Kimberley TJ, Lewis SM, et al. Analysis of fMRI and finger tracking training in subjects with chronic stroke.
Brain 2002;125(pt 4):773-88. - Carey JR, Durfee WK, Bhatt E, et al. Comparison of finger tracking versus simple movement training via
telerehabilitation to alter hand function and cortical reorganization after stroke. Neurorehabil Neural Repair
2007;21:216-32. - Giudice M.L. Effects of Continuos Passive Motion and elevation on hand edema. The American Journal of
Occupational Theraphy, 1990; Oct; 44(10):914-21. - Dirette D., Hinojosa J. Effects of continuos passive motion on the edematous hands of two persons with flaccid
hemiplegia. The American Journal of Occupational Theraphy, 1994; May; 48(5):403-409. - Xu X.L., Tong R.K., Song R., Zheng X.J., Leung W. W. A comparison between electromyography-driven robot and
passive motion device on wrist rehabilitation for chronic stroke. Neurorehabiltation and neural repair, 2009; Jun 16 - Williams P E, Catanese T, Lucey E G, Goldspink G: The importance of stretch and contractile activity in the prevention
of connective tissue accunulation in muscle. J Anat 1988; 158: 109-114. - Seitz et al. A common frame work for perceptual learning. Curr. Neurobiol 2007, 17:1-6.
- Winter et al. Hands-on theraphy intervention for upper limb motor dysfunction following stroke. Cochrane Database
Syst Rev 2011 Jun 15; 6:CD006609. - Hwang CH, Seong JW, Son DS. Individual finger synchronized robot-assisted hand rehabilitation in subacute to
chronic stroke: a prospective randomized clinical trial of efficacy. Clinical Rehabilitation 2012;26(8); 696–704. - Lee MM, Cho HY, Song CH. The mirror therapy program enhances upper-limb motor recovery and motor function in
acute stroke patients. Am J Phys Med Rehabil 2012;91(8):689-96 - Sale P, Franceschini M. Action observation and mirror neuron network: a tool for motor stroke rehabilitation. Eur J
Phys Rehabil Med. 2012 Jun;48(2):313-8. Epub 2012 Apr 20. - Szameitat AJ, Shen S, Conforto A, Sterr A. Cortical activation during executed, imagined, observed, and passive wrist
movements in healthy volunteers and stroke patients. Neuroimage. 2012 Aug 1;62(1):266-80. doi:
10.1016/j.neuroimage.2012.05.009. Epub 2012 May 11 - August K, Lewis JA, Chandar G, Merians A, Biswal B, Adamovich S. FMRI analysis of neural mechanisms underlying
rehabilitation in virtual reality: activating secondary motor areas. Conf Proc IEEE Eng Med Biol Soc. 2006;1:3692-5. - Tunik E, Saleh S, Adamovich SV. Visuomotor discordance during visually-guided hand movement in virtual reality
modulates sensorimotor cortical activity in healthy and hemiparetic subjects. IEEE Trans Neural Syst Rehabil Eng. 2013
Mar;21(2):198-207. doi: 10.1109/TNSRE.2013.2238250. Epub 2013 Jan 9. - Saleh S, Bagce H, Qiu Q, Fluet G, Merians A, Adamovich S, Tunik E. Mechanisms of neural reorganization in chronic
stroke subjects after virtual reality training. Conf Proc IEEE Eng Med Biol Soc. 2011;2011:8118-21. doi:
10.1109/IEMBS.2011.6092002. - Tunik E, Adamovich SV. Remapping in the ipsilesional motor cortex after VR-based training: a pilot fMRI study. Conf
Proc IEEE Eng Med Biol Soc. 2009;2009:1139-42. doi: 10.1109/IEMBS.2009.5335392.
Czy interesujesz się rehabilitacją?
Zapisz się na nasz newsletter, abyśmy mogli Ci przesyłać informacje i aktualności w zakresie rehabilitacji, w tym informacje o nowych artykułach, webinarach, szkoleniach czy wydarzeniach branżowych.