- Proszę czekać...
Pierwsze zastosowanie PBMT w leczeniu COVID-19

Drabinka gimnastyczna – domowa siłownia
28.07.2020
Film prezentujący historię firmy
30.09.2020Temat pracy:
Pierwsze zastosowanie PBMT w leczeniu COVID-19: odpowiedź terapeutyczna na wspomagające leczenie fotobiomodulacją (PBMT) u 57-letniego Afroamerykanina z ostrym zapaleniem płuc w przebiegu COVID-19
Informacje o pacjencie:
- Pacjent: Mężczyzna, 57 lat
- Diagnoza ostateczna: COVID-19
- Objawy: Duszność, hipoksja
- Leki: brak
- Postępowanie kliniczne: Terapia fotobiomodulacyjna (PBMT)
- Specjalizacja: Choroby zakaźne, pulmonologia
Przedmiot badania:
Cel: Niezwykły lub nieoczekiwany efekt stosowanej terapii
Wprowadzenie: COVID-19 to jednostka chorobowa związana z zapaleniem płuc i burzą cytokin. Terapia fotobiomodulacyjna (PBMT) to bezpieczna, nieinwazyjna terapia o istotnym działaniu przeciwzapalnym, stosowana w leczeniu wspomagającym pacjentów z chorobami płuc. Badania na ludziach i eksperymentalne modele chorób układu oddechowego wskazują, że PBMT zmniejsza stan zapalny i wspomaga leczenie płuc. Niniejszy opis przypadku referuje pierwsze zastosowania wspomagającej PBMT w ostrym zapaleniu płuc w przebiegu COVID-19.
Opis przypadku: 57-letni Afroamerykanin z ciężkim COVID-19 otrzymał po jednej sesji PBMT przez kolejne 4 dni za pomocą skanera laserowego w trybie przerywanym 808 nm i super-impulsowym 905 nm przez 28 min/1 zabieg. Stan pacjenta był oceniany przed i po leczeniu na podstawie radiologicznej oceny obrzęku płuc (RALE) z wykorzystaniem RTG klatki piersiowej, oraz na podstawie wskaźników ciężkości zapalenia płuc, badań krwi, zapotrzebowania na tlen i kwestionariuszy pacjenta. Saturacja tlenem (SpO2) wzrosła z 93 – 94% do 97 – 100%, podczas gdy zapotrzebowanie na tlen spadło z 2–4 l/min do 1 l/min. Wynik RALE poprawił się z 8 do 5. Wskaźnik ciężkości zapalenia płuc poprawił się z klasy V (142) do klasy II (67). Dodatkowe wskaźniki płucne (Brescia-COVID i SMART-COP) zmniejszyły się z 4 do 0. Osiągnięto normalizację CRP z 15,1 do 1,23. Pacjent zgłosił znaczną poprawę w badaniu z wykorzystaniem narzędzia oceny pozaszpitalnego zapalenia płuc.
Wnioski: W raporcie przedstawiono leczenie wspomagające z wykorzystaniem terapii fotobiomodulacyjnej (PBMT) u pacjenta z ostrym zapaleniem płuc COVID-19. Wskaźniki oddechowe, wyniki radiologiczne, zapotrzebowanie na tlen i objawy pacjenta poprawiły się w ciągu kilku dni, i to bez konieczności stosowania respiratora. Konieczne są dalsze kontrolowane badania kliniczne, aby ocenić wpływ PBMT na wyniki kliniczne pacjentów z zapaleniem płuc wywołanym przez COVID-19.
Wprowadzenie – PBMT w leczeniu COVID-19
Choroba koronawirusa 2019 (COVID-19) jest wywołana zakażeniem wirusem SARS-CoV-2. Objawy COVID-19 obejmują duszność, obrzęk płuc i zapalenie płuc. Zachorowalność i śmiertelność są związane z zespołem ostrej niewydolności oddechowej (ARDS) i burzą cytokin. Stan hospitalizowanych pacjentów z COVID-19 jest klasyfikowany jako ciężki, jeśli wymagają przyjęcia na oddział intensywnej terapii (OIT) [1,2]. W tym artykule przedstawiamy pierwsze zastosowanie terapii fotobiomodulacyjnej (PBMT) jako leczenia wspomagającego u pacjenta z ciężkim zapaleniem płuc wywołanym przez COVID-19.
Co to jest Terapia fotobiomodulacyjna (PBMT)
Terapia fotobiomodulacyjna (PBMT) to wyłaniająca się alternatywna metoda o udowodnionym działaniu przeciwzapalnym w leczeniu bólu, obrzęku limfatycznego, gojeniu ran i urazów mięśniowo-szkieletowych. PBMT określana jest również jako laseroterapia niskoenergetyczna (lub światłem) (LLLT), zimny laser i fotobiostymulacja [3]. Efekty PBMT różnią się od efektów termicznych wywoływanych przez lasery dużej mocy stosowane w zabiegach kosmetycznych i chirurgicznych do niszczenia tkanki [4,5]. PBMT wykorzystuje niejonizujące, nietermiczne źródła światła w zakresie widzialnym i podczerwonym (400–1000 nm) [3]. W PBMT światło jest aplikowane na uszkodzone tkanki, a energia światła pochłaniana przez wewnątrzkomórkowe chromofory lub biomolekuły zapoczątkowuje kaskadę reakcji molekularnych, które poprawiają funkcjonowanie komórek i przyspieszają procesy naprawcze [4]. W efekcie światło stymuluje leczenie, moduluje układ odpornościowy, zmniejsza stan zapalny, obrzęk i ból [4]. PBMT jest nieinwazyjna, efektywna kosztowo i nie ma znanych skutków ubocznych.
Wpływ terapii fotobiomodulacyjnej (PBMT) u chorych na COVID-19
Empiryczne stosowanie PBMT u dzieci, dorosłych i osób starszych z zapaleniem płuc, astmą, przewlekłym zapaleniem oskrzeli lub zwłóknieniem płuc skutkowało zmniejszeniem bólu i ciężkości w klatce piersiowej, normalizacją czynności oddechowej, skróceniem czasu powrotu do zdrowia oraz poprawą parametrów immunologicznych i radiologicznych. U tych pacjentów PBMT stosowane w połączeniu z konwencjonalnym leczeniem było bezpieczne i wywierało synergiczny efekt w procesie leczenia [6–10]. W ostatnio ukazujących się publikacjach zaleca się stosowanie wspomagającej PBMT u chorych na COVID-19 [11–13]. ARDS jest krytycznym powikłaniem zakażenia COVID-19, a wspomagająca PBMT może złagodzić ARDS i sprzyjać leczeniu płuc [11, 13–18]. Modele zwierzęce ostrego zapalenia układu oddechowego sugerują, że przezskórna PBMT płuc jest skuteczna w zwalczaniu burzy cytokin i ARDS dzięki jej wielopoziomowu działaniu przeciwzapalnemu [14–18].
Wspomagający leczenie efekt stosowania PBMT w przebiegu COVID 19 opiera się na oddziaływaniu lasera na tkankę płuc, które redukuje stan zapalny i promuje procesy naprawcze. The World Association for Laser Therapy zaleciło w 2010r.[19] zróżnicowane dawki lecznicze do stosowania w laseroterapii niskoenergetycznej, czyli PBMT, w zależności od głębokości umiejscowienia zmian w schorzeniach mięśniowo-szkieletowych. Minimalna dawka terapeutyczna o działaniu biostymulującym dla laserów czerwonych i bliskiej podczerwieni (NIR) wynosi 0,01 J / cm2 [20]. Światło lasera NIR o mocy 1 W / cm2 przepuszczane przez tkankę bydlęcą o grubości od 1,8 do 9,5 cm dało efektywne gęstości mocy na głębokości 3,4 cm i 6,0 cm [21]. W praktyce weterynaryjnej zapalenie płuc u kotów i psów jest często leczone laserem w dawkach 6 – 10 J / cm2 [22]. Zwierzęta te mają grubszą ścianę klatki piersiowej i skórę pokrytą sierścią, co sprawia, że penetracja wiązki lasera jest trudniejsza niż u ludzi. Dlatego zakres stosowany u kotów i psów jest zbliżony do skutecznej dawki dla ludzi.
Nasze wcześniejsze doświadczenia w leczeniu astmy [23] oraz bólu mięśniowo-szkieletowego i urazów wskazywały, że przeciwzapalne działanie PBMT może korzystnie wpływać na ciężki stan zapalny u pacjentów z COVID-19. Urządzenie laserowe zastosowane w tym przypadku to zatwierdzony przez Amerykańską Agencję ds. Żywności i Leków (FDA) system do leczenia bólu i redukcji stanów zapalnych w głębokich stawach ciała. Kombinacja 808 i 905 nm, obie długości fal w zakresie NIR, zapewnia penetrację na głębokości 4 – 5,4 cm. Zastosowane urządzenie laserowe jest używane do terapii stosunkowo głęboko położonych tkanek, takich jak biodra i stawy miednicy, które są otoczone grubymi warstwami mięśni. Dawka terapeutyczna potrzebna do dotarcia przez laser do głęboko położonych miejsc w miednicy wynosi 4,5 J/cm2 skóry. Na podstawie naszych obliczeń zastosowaliśmy dawkę 7,2 J/cm2 na skórze, aby dostarczyć nieco ponad 0,01 J/cm2 energii lasera do płuc. Dawka 7,2 J/cm2 przenika przez ścianę klatki piersiowej (1,6 do 6 cm u ludzi) i dociera do tkanki płuc z energią wystarczającą do biostymulacji. Protrakcja łopatek w pozycji na brzuchu powoduje zmniejszenie tkanki kostnej i mięśniowej, przez które musi przeniknąć laser, zwiększając w ten sposób energię lasera docierającą do pól płucnych.
Przedmiotem niniejszego opisu przypadku jest pierwsze zastosowanie PBMT jako leczenia wspomagającego w ciężkim przypadku zapalenia płuc COVID-19.
Opis przypadku
Pacjent to 57-letni Afroamerykanin z nadciśnieniem i astmą w wywiadzie, hospitalizowany z objawami duszności, poważnie odwodniony, z ostrą niewydolnością nerek i biegunką wywołaną przez C. difficile. Badanie przedmiotowe wykazało utrudniony oddech, osłabienie i zmęczenie.
Wykonanie Rtg klatki piersiowej wykazało: nasilające się nacieki w płucach. Zapotrzebowanie na tlen w szpitalu wahało się od 2 do 6 l/min. Pacjent uprzednio przebywał na oddziale intensywnej terapii z powodu niewydolności oddechowej z SpO2 80%, wymagając 48 godzin podawania tlenu 6 l/min. Rozpoznanie SARS-CoV-2 potwierdzono u tego pacjenta na podstawie reakcji łańcuchowej polimerazy z odwrotną transkrypcją w wymazie z nosogardła w systemie Abbott ID. Uzyskano zgodę pacjenta na przeprowadzoną pod kierownictwem FDA i zatwierdzoną przez międzynarodową komisję weryfikacyjną próbę leczenia COVID-19 z zastosowaniem lasera. Kryteria włączenia obejmowały pozytywny wynik testu COVID-19, zdolność do ułożenia na brzuchu i wymaganie co najmniej 1 l O₂/min.
Parametry lasera u pacjentów z zapaleniem płuc COVID-19
| 808 nm (GaAlAs) diode | 905 nm (GaAs) diode | |
| Tryb pracy | Przerywany | Impulsowy |
| Częstotliwość | 1500 Hz, (Cykl pracy 50%) (1 Hz÷2 kHz) | 1500 Hz, (90 kHz modulowany przy 1 Hz÷2 kHz) |
| Czas impulsu | 333 μs (500 ms÷250 μs) | 100 ns |
| Moc szczytowa | 3 W | 75W × 3 |
| Moc średnia | 1.5 W | 11.25 × 3=33.75 mW |
| Rozmiar plamki | 19.625 cm2 | |
| Powierzchnia skanowania | Każde płuco 25×10=250 cm2 | |
| Dawka | 7.1–7.2 J/cm2 | |
| Odległość od skóry | 20 cm | |
| Czas zabiegu | 14 min. każde płuco | |
| Energia całkowita | 3600 J 1794.24 każde płuco |
|
| Czas całkowity | 28 min | |
| Zabiegi | Raz dziennie przez 4 dni | |
tabela 1
W tabeli przedstawiono parametry dawkowanej energii lasera i czas zabiegu zastosowane w opisywanym przypadku.
- GaAlAs – dioda galo-arsenek glinu;
- GaAs – dioda arsenek galu;
Obie diody są częścią jednego systemu laserowego: Multiwave Locked System (MLS). Istnieje możliwość wyboru nastawu systemu zależnej od ilości pigmentu w skórze pacjenta. Po aktywacji tej funkcji przyciskiem na konsoli aparatu natężenie lasera zmniejsza się o 50%, a oprogramowanie automatycznie oblicza nową wymaganą dawkę.
Pacjent był leczony za pomocą zatwierdzonego przez FDA lasera terapeutycznego Multiwave Locked System (MLS). Użyty aparat MLS wykorzystuje mobilny skaner z 2 zsynchronizowanymi diodami laserowymi: jedną w trybie impulsowym (1–2000 Hz), emitującą falę 905 nm i drugą w trybie przerywanym emitującą falę 808 nm. Dwie wiązki lasera działają jednocześnie i synchronicznie. Laser ten jest stosowany do leczenia bólu mięśniowo-szkieletowego i stanów zapalnych. Parametry lasera ustalono zgodnie z tabelą 1 i rysunkiem 1. Skaner laserowy ustawiono na 20 cm nad skórą, zgodnie z zaleceniami producenta. Każde płuco skanowano przez 14 minut od szczytu do podstawy na powierzchni 250 cm2 tylnej ściany klatki piersiowej (tab. 1, rys. 1, 2).
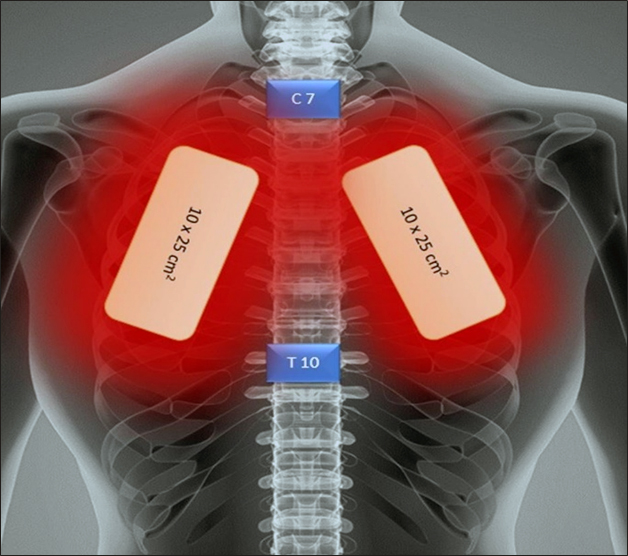
rysunek 1
Orientacja wiązek lasera podczas zabiegu laserowego w pozycji na brzuchu. Szczyt płuca znajduje się powyżej pierwszego żebra. Płuca rozciągają się od kręgu C7 (szczyt płuca) do T10 (podstawa płuca). Parametry lasera przy obu diodach działających synchronicznie i jednocześnie oraz przy pokrywających się osiach propagacji. 1) Dioda (GaAlAs) 808 nm: Moc szczytowa: 3 W, Tryb pracy: Przerywany, Częstotliwość: 1500 Hz, Czas impulsu: 333 μs, Powierzchnia skanowania: 25×10=250 cm2, Dawka: 7.2 J/cm2; 2) Dioda (GaAs) 905 nm: Moc szczytowa: 75 W×3, Tryb pracy: Impulsowy, Częstotliwość: 1500 Hz, Czas impulsu: 100 ns, Powierzchnia skanowania: 25×10=250 cm2, Dawka: 113.4 mJ/cm2; Energia całkowita: 3600 J. Czas zabiegu: (28 min), 14 min każde płuco, Sesje: Codziennie jedna sesja przez 4 dni. Protokół terapeutyczny: PBMT-COVID-19 Dr. S. Mokmeli.
Aby poprawić penetrację lasera do tkanki płucnej, zastosowano specyficzne ułożenie pacjenta na brzuchu z rękami pod głową, co zapewniło maksymalną trakcję łopatek w kierunku głowy. Pole laserowe zostało skupione na przyśrodkowej granicy łopatki, otwierając w ten sposób drogę do pól płucnych. Osiągnięta minimalizacja grubości ściany klatki piersiowej poprawia penetrację lasera do tkanki płucnej
Przed zabiegiem laserowym pacjent był obłożnie chory i przykuty do łóżka, z SpO2 92–95%, 2–4 l/min O2. Ukończył cykl antybiotykowy i nie otrzymywał żadnego wsparcia farmakoterapeutycznego ani dożylnego. Występowały u niego ciężkie epizody napadowego kaszlu, nie powiodła się próba terapii fizykalnej. Pacjent tolerował pozycję na brzuchu do leczenia laserem łącznie przez 28 min w czasie każdego zabiegu. Podczas 5 minut pierwszego zabiegu laserowego nasycenie tlenem wzrosło z 94% do 100%. Po zabiegu pacjent wrócił do łóżka i zajął ponownie pozycję półsiedzącą, a SpO2 utrzymywało się na poziomie 98% przez resztę dnia.
Bezpośrednio po każdym z 4 zabiegów pacjent mógł znacznie łatwiej oddychać. Napadowe ataki kaszlu ustąpiły po trzecim zabiegu. Po czwartym zabiegu pacjent był już w stanie poruszać się po gabinecie fizjoterapii. Następnego dnia po ostatnim zabiegu chory został przeniesiony na oddział rehabilitacji przy dawce tlenu 1 l/min. W dzień po przybyciu do oddziału rehabilitacji chory był w stanie wykonać 2 próby wchodzenia po schodach w ramach fizjoterapii oraz rozpoczął się proces odstawiania terapii tlenowej.
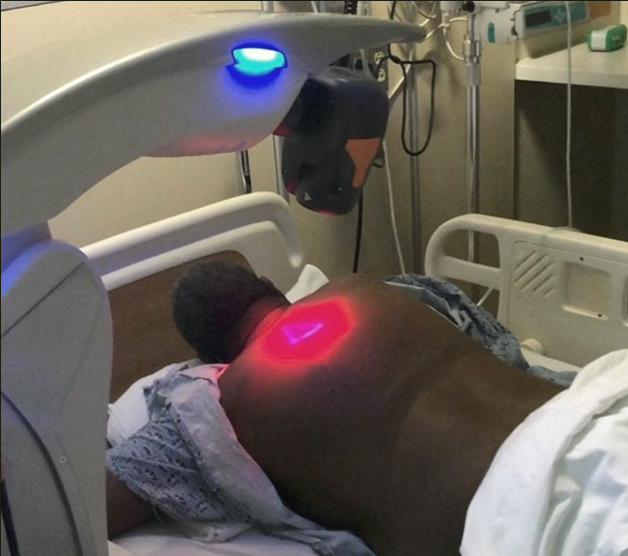
rysunek 2
Ustawienie skanera laserowego. Pacjent leży na brzuchu z rękami pod głową, aby uzyskać maksymalną protrakcję łopatek. Skaner znajduje się 20 cm nad skórą, zgodnie z wytycznymi producenta. Czerwone światło to promień wodzący lasera na skórze. Lasery podczerwone o długości fal 808 i 905 nm są niewidoczne. Dwa źródła laserowe są połączone w jednym systemie laserowym MLS.
Odpowiedź pacjenta na PBMT oceniano stosując różne metody ewaluacyjne przed i po laseroterapii. Pacjent wykazał poprawę we wszystkich kryteriach oceny (tab. 2).
Wskaźnik nasilenia zapalenia płuc (Pneumonia Severity Index, PSI) [24] stosuje się do obliczania prawdopodobieństwa zachorowalności i śmiertelności wśród pacjentów z pozaszpitalnym zapaleniem płuc (CAP). Przed leczeniem wynik PSI pacjenta odpowiadał klasie V (142), co wskazuje na konieczność leczenia na OIT i przewiduje intubację oraz użycie respiratora. Po PBMT PSI spadło do klasy II (67), co oznacza leczenie ambulatoryjne.
Wynik SMART-COP [25], który jest akronimem dla ciśnienia skurczowego krwi, nacieków wielopłatowych, albuminy, częstości oddechów, tachykardii, splątania, tlenu i pH, ocenia ciężkość zapalenia płuc i przewiduje potrzebę wdrożenia respiratoroterapii i/lub zastosowania leków naczynioskurczowych (Intensive Respiratory or Vasopressor Support, IRVS ) w CAP. Wynik SMART-COP przed leczeniem wynosił 5, co plasowało chorego w grupie wysokiego ryzyka i oznaczało 30% prawdopodobieństwo konieczności zastosowania IRVS. Po zastosowaniu PBMT
Skala ciężkości oddechu – Brescia-COVID (BCRSS) (ang. Brescia-COVID Respiratory Severity Scale) [26] to krokowy algorytm postępowania z pacjentami z potwierdzonym COVID-19. Przed leczeniem wynik BCRSS pacjenta wynosił 4 z 4, co wymaga stosowania kaniuli donosowej o wysokim przepływie (HFNC) oraz ponownej oceny i intubacji, jeśli wynik pozostaje > 2. Po PBMT wynik BCRSS pacjenta wyniósł 0, co oznacza jedynie wymóg monitorowania pacjenta
CAP tool score [27] to krótki i czuły kwestionariusz oceniający zmiany objawów ze strony układu oddechowego i samopoczucia CAP tool score [27] to krótki i czuły kwestionariusz oceniający zmiany objawów ze strony układu oddechowego i samopoczucia podczas leczenia pozaszpitalnego zapalenia płuc (Community Acquired Pneumonia, CAP). Wyniki < 75% wskazują na zaburzenia oddechowe. CAP score pacjenta przed leczeniem wynosił 36,68% i wzrósł do 82,84% po leczeniu. Jego CAP Respiratory Score poprawił się z 67,52% przed leczeniem do 87,17% przy wypisie. CAP Well-Being score wzrósł z 0% przed leczeniem do 73,07% po leczeniu. Omawiany pacjent wykazał znaczną poprawę we wszystkich 3 pomiarach objawów ze strony układu oddechowego.
Skala radiologicznej oceny obrzęku płuc (Radiographic Assessment of Lung Edema, RALE) [28,29] ocenia obrzęk płuc na podstawie RTG klatki piersiowej u pacjentów z ARDS. W celu ilościowego określenia zakresu zakażenia obliczono skalę jego ciężkości [29]. Każdemu płucu przypisano wynik od 0 do 4 w zależności od procentu zagęszczenia tkanki płucnej wskutek nacieku lub zacienienia typu matowego szkła, gdzie 0 oznacza brak zajęcia płuc, 1 oznacza 75%. Wyniki dla każdego płuca zostały zsumowane, aby otrzymać ostateczną ocenę ciężkości [29]. Wynik RALE wyniósł 8 (> 75% zajęcia obu płuc) i poprawił się do 5 po zakończeniu leczenia (rys. 3).
Po zakończeniu leczenia liczba białych krwinek spadła z 10,7 do 6,5, a białko C-reaktywne zmniejszyło się z 15,1 do 1,23. Zapotrzebowanie na tlen przed leczeniem wynosiło 2–4 l/min przy saturacji (SpO2) 93–94%. Po zakończeniu leczenia zapotrzebowanie na tlen spadło do 1 l/min przy SpO2 97–100% przy wypisie.
Dyskusja
Jak wynika z opisu przypadku, 4 codzienne sesje (1 sesja dziennie przez 4 kolejne dni) wspomagającej PBMT były korzystne u pacjenta z ciężkimi objawami COVID-19. Pozytywną odpowiedź pacjenta na leczenie potwierdziły wyniki badań radiologicznych, oceny ciężkości zaburzeń oddechowych, spadek zapotrzebowanie na tlen, markery krwi i stanu zapalnego oraz kwestionariusze pacjenta. W okresie obserwacji po wypisie całkowity powrót do zdrowia wyniósł 3 tygodnie, podczas gdy mediana czasu powrotu do zdrowia w przypadku COVID-19 wyniosła 6–8 tygodni [30].
Kryteria oceny przed terapią fotobiomodulacyjną i po jej zakończeniu u pacjenta z COVID-19.
| Parametry | Przed terapią | Po terapii | Zakres prawidłowy lub kryteria oceny |
| PSI | Klasa V (142) | Klasa II (67) |
|
| SMART-COP | 5 | 2 |
|
| Brescia-COVID | 4 | 0 |
|
| CAP całkowity | 36.68 | 82.82 |
|
| CAP oddechowy | 67.52 | 87.17 | 75–100% |
| CAP samopoczucie | 0.0 | 73.07 | 75–100% |
| RALE | 8 | 5 | Punktacja płuc zależy od stopnia zajęcia w oparciu o zagęszczenie tkanki płucnej wskutek nacieku lub zacienienie typu matowego szkła dla każdego płuca. Wynik całkowity jest sumą wyników dla płuc: 0 – brak zajęcia płuc; 1 – 75% zajęcia płuc. |
| WBC | 10.7 | 6.5 | 4.5–11 |
| CRP | 15.1 | 1.23 | 3 mg/mL |
| O2 Requirement | 2–3 L/min | 1 L/min | 0 L/min |
| SpO2 | 93–94% | 100% | ≥ 94% |
tabela 2
PSI, Pneumonia Severity Index – Wskaźnik nasilenia zapalenia płuc; SMART-COP, Systolic blood pressure, Multilobar infiltrates, Albumin, Respiratory rate, Tachycardia, Confusion, Oxygen, and pH – ciśnienie skurczowe krwi, nacieki wielopłatowe, albuminy, częstość oddechów, tachykardia, splątanie, tlen i pH,; CAP, Community-Acquired Pneumonia – pozaszpitalne zapalenie płuc; RALE, Radiographic Assessment of Lung Edema – radiologiczna ocena obrzęku płuc; SpO2 – saturacja tlenem; WB, White Blood Cells – leukocyty; CRP, C-Reactive Protein – białko C-reaktywne; IRVS, Intensive Respiratory or Vasopressor Support – respiratoroterapia i/lub zastosowanie leków naczynioskurczowych; CXR, Chest x-ray – RTG klatki piersiowej; ABG, Arterial Blood Gas – gazometria; HFNC, High-Flow Nasal Cannula – kaniula donosowa o wysokim przepływie.
Uważa się, że terapeutyczny wpływ PBMT na zapalenie płuc odbywa się poprzez oddziaływania miejscowe i ogólnoustrojowe, które redukują cytokiny stanu zapalnego, nacieki komórkowe, obrzęki i zwłóknienie oraz zwiększają ilość cytokin przeciwzapalnych i procesów przeciwzapalnych oraz wspomagają gojenie. Lokalna PBMT oddziałuje na całe ciało poprzez jej fotoprodukty, które są rozprowadzane przez układ naczyniowy i docierają do odległych miejsc docelowych. Aktywowane fotoprodukty prowadzą do złagodzenia stanu zapalnego i pobudzają procesy immunomodulacji, stymulują gojenie się ran i regenerację tkanek [4]. Badania na zwierzętach demonstrują siłę oddziaływania PBMT.
Przezskórna PBMT w mysich modelach zwłóknienia płuc i ARDS istotnie zredukowała prozapalne cytokiny, komórki zapalne i odkładanie włókien kolagenowych w miąższu płuc [14–18]. Odnotowano natomiast istotny wzrost ilości przeciwzapalnej cytokiny interleukiny-10, monocytów surowicy i makrofagów płuc po PBMT [15,17]. Molekularne podłoże przeciwzapalnego działania lasera MLS wykazano na modelach mysich i in vitro [31–33]. W szczególności wykazano, że laser MLS hamuje aktywację inflamasomu, hamując interleukinę-1b i interleukinę-18, których dalsze przekazywanie sygnałów indukuje produkcję interleukiny-6, interleukiny-8, czynnika martwicy nowotworu a (TNF-a) i interferonu-g , które są zaangażowane w ARDS wywołany zakażeniem COVID-19 [14–18, 31–33].
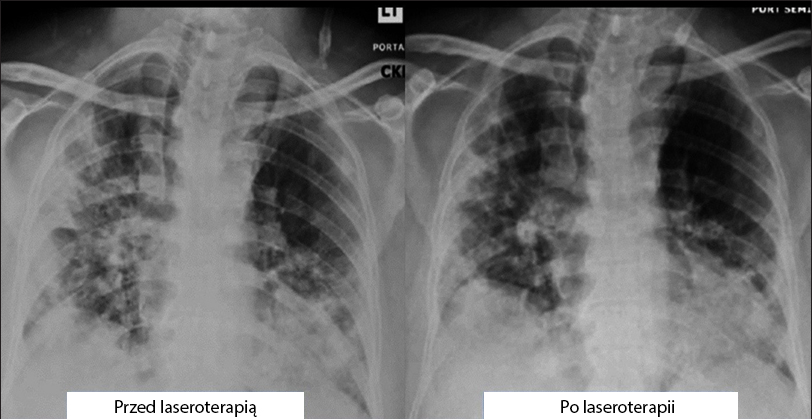
rysunek 3
Radiograficzna ocena obrzęku płuc (RALE) metodą RTG klatki piersiowej wykazała redukcję zagęszczenia tkanki płucnej i zacienienia typu matowego szkła po PBMT. Ocena radiologiczna płuc zależy od stopnia zajęcia na podstawie zagęszczenia lub zacienienia typu matowego szkła w każdym płucu. Całkowity wynik to suma punktów uzyskanych dla obu płuc. Klasyfikacja punktowa: 0 – brak zajęcia płuc; 1 – zajęcie płuc 75%. Wynik RALE przed laseroterapią (27.04.2020) = 8. Laseroterapię rozpoczęto 29.04.2020 r. Wynik RALE po laseroterapii (05-03-2020) = 5.
Wnioski z badań po zastosowaniu PBMT u chorego na COVID-19
Badania na ludziach wykazały miejscowe i ogólnoustrojowe oddziaływanie PBMT po jej zastosowaniu na mięsień czworogłowy uda u pacjentów z przewlekłą obturacyjną chorobą płuc [10]. Korzystne efekty wykraczały poza poprawę wydolności mięśniowej, aż do statystycznie istotnej redukcji duszności i zmęczenia [10]. Nasz pacjent zgłosił również subiektywne odczucie poprawy funkcji oddechowej i siły.
Omawiany pacjent został umieszczony w pozycji leżącej tylko na czas leczenia laserem. Zabiegi trwały dokładnie 28 minut w każdym z 4 dni. Dowody fizjologiczne i dane z badań klinicznych przemawiają za stosowaniem wentylacji w pozycji na brzuchu u wybranych pacjentów z ARDS od umiarkowanego do ciężkiego. Aby odnieść korzyść terapeutyczną, konieczne są długie sesje ułożenia na brzuchu, trwające od 12 do 18 godzin na sesję [34,35]. Wzrost SpO2 z 94% do 100% wystąpił w ciągu pierwszych 5 minut zabiegu, a następnie efekt dobrej saturacji utrzymywał się. Uzyskane wyniki wskazują, że zastosowanie PBMT pozwala na szybką poprawę saturacji. Jest mało prawdopodobne, aby w omawianym przypadku samo ułożenie na brzuchu było przyczyną poprawy natlenienia, biorąc pod uwagę bardzo krótki czas ułożenia pacjenta w tej pozycji.
Podkreślić należy, że przedstawiony opis przypadku zawiera dane zebrane przed i po leczeniu. Wszystkie 4 narzędzia do oceny płuc i 3 kwestionariusze pacjentów wykazały korzyści z leczenia. Zgodnie z naszą najlepszą wiedzą był to pierwszy przypadek zastosowania PBMT w leczeniu wspomagającym zapalenia płuc u pacjenta z COVID 19. Napromienianie płuc w projekcji tylnej metodą skanowania nie stwarza ryzyka zakażenia, ponieważ urządzenie nie ma fizycznego kontaktu z ciałem pacjenta. Wadą przedstawionego opisu przypadku jest brak informacji o markerach stanu zapalnego i badań krwi. Przyszłe badania powinny obejmować wykonane przed i po leczeniu pomiary interleukiny-6, interleukiny-10, TNF-a, a także dodatkowych markerów zapalenia. Ograniczeniem tego opisu przypadku jest również to, że dotyczy on wyłącznie jednego pacjenta, w związku z czym autorzy nie byli w stanie przeprowadzić żadnej analizy statystycznej.
Podsumowanie
W raporcie przedstawiono przypadek chorego z ciężkim zapaleniem płuc związanym z ARDS w przebiegu COVID-19, u którego zastosowano PBMT jako leczenie wspomagające. Opierając się na tym przypadku, a także na doświadczeniu klinicznym dotyczącym stosowania PBMT w chorobach dróg oddechowych, uważamy PBMT za obiecującą metodę leczenia wspomagającego COVID-19. Ponadto opublikowane wyniki badań eksperymentalnych wykazują przeciwzapalne działanie PBMT na tkankę płucną. Sugerujemy, że stosowanie wspomagającego PBMT we wczesnych stadiach ciężkiego ARDS obserwowanego u pacjentów z COVID-19 może poprawić gojenie i zmniejszyć potrzebę długiego wspomagania respiratorem i pobytu na OIT. Trudna obecna sytuacja medyczna wymaga przeprowadzenia pilotażowych badań PMBT i badań klinicznych w celu oceny jej wpływu na zapalenie płuc wywołane przez COVID-19. Opisany przypadek włączono do trwającego randomizowanego, kontrolowanego badania klinicznego.
Bibliografia
- 1. Liang T: Handbook of COVID-19 prevention and treatment. Zhejiang University School of Medicine, March 2020
- 2. Huang C, Wang Y, Li X et al: Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China [published correction appears in Lancet. 2020 Jan 30;]. Lancet, 2020; 395(10223): 497–506
- 3. Anders JJ, Lanzafame RJ, Arany PR: Low-level light/laser therapy versus pho- tobiomodulation therapy. Photomed Laser Surg, 2015; 33(4): 183–84
- 4. Cotler HB, Chow RT, Hamblin MR, Carroll J: The use of low-level laser ther- apy (LLLT) for musculoskeletal pain. MOJ Orthop Rheumatol, 2015; 2(5): 00068
- 5. Hamblin MR: Mechanisms and applications of the anti-inflammatory ef- fects of photobiomodulation. AIMS Biophys, 2017; 4(3): 337–61
- 6. Amirov NB [Parameters of membrane permeability, microcirculation, ex- ternal respiration, and trace element levels in the drug-laser treatment of pneumonia]. Ter Arkh, 2002; 74(3): 40–43 [in Russsian]
- 7. Derbenev VA, Mikhailov VA, Denisov IN: Use of low-level laser therapy (LLLT) in the treatment of some pulmonary diseases: Ten-year experience. Proceedings of the SPIE, Volume 4166; 1999 Oct 28–31; Florence, Italy. SPIE digital library 2000; 323–25
- 8. Ostronosova NS: [Outpatient use of laser therapy in bronchial asthma.] Ter Arkh, 2006; 78(3): 41–44 [in Russsian]
- 9. Mehani SHM: Immunomodulatory effects of two different physical therapy modalities in patients with chronic obstructive pulmonary disease. J Phys Ther Sci, 2017; 29(9): 1527–33
- 10. Miranda EF, de Oliveira LV, Antonialli FC et al: Phototherapy with combi- nation of super-pulsed laser and light-emitting diodes is beneficial in im- provement of muscular performance (strength and muscular endurance), dyspnea, and fatigue sensation in patients with chronic obstructive pul- monary disease. Lasers Med Sci, 2015; 30(1): 437–43
- 11. Enwemeka CS, Bumah VV, Masson-Meyers DS: Light as a potential treat- ment for pandemic coronavirus infections: A perspective. J Photochem Photobiol B, 2020; 207: 111891
- 12. Fekrazad R: Photobiomodulation and antiviral photodynamic therapy as a possible novel approach in COVID-19 management. Photobiomodul Photomed Laser Surg, 2020; 38(5): 255–57
- 13. Mokmeli S, Vetrici M: Low-level laser therapy as a modality to attenuate cytokine storm at multiple levels, enhance recovery, and reduce the use of ventilators in COVID-19. Can J Respir Ther, 2020; 56: 1–7
- 14. Aimbire F, Lopes-Martins RA, Albertini R et al: Effect of low-level laser therapy on hemorrhagic lesions induced by immune complex in rat lungs. Photomed Laser Surg, 2007; 25(2): 112–17
- 15. de Brito AA, da Silveira EC, Rigonato-Oliveira NC et al: Low-level laser ther- apy attenuates lung inflammation and airway remodeling in a murine mod- el of idiopathic pulmonary fibrosis: Relevance to cytokines secretion from lung structural cells. J Photochem Photobiol B, 2020; 203: 111731
- 16. Cury V, de Lima TM, Prado CM et al: Low-level laser therapy reduces acute lung inflammation without impairing lung function. J Biophotonics, 2016; 9(11–12): 1199–207
- 17. da Cunha Moraes G, Vitoretti LB, de Brito AA et al: Low-level laser therapy reduces lung inflammation in an experimental model of chronic obstructive pulmonary disease involving P2X7 receptor. Oxid Med Cell Longev, 2018; 2018: 6798238
- 18. Miranda da Silva C, Peres Leal M, Brochetti RA et al: Low-level laser ther- apy reduces the development of lung inflammation induced by formalde- hyde exposure. PLoS One, 2015; 10(11): e0142816
- 19. WALT: Dosage recommendations. Recommended treatment doses for low- level laser therapy. Available at URL: https://waltza.co.za/documentation- links/recommendations/dosage-recommendations/; https://waltza.co.za/ app/uploads/2012/08/Dose_table_904nm_for_Low_Level_Laser_ Therapy_WALT-2010.pdf
- 20. Tunér J, Hode L: Laser therapy, clinical practice and scientific background. Grängesberg, Sweden: Prima Books AB; 2002
- 21. Hudson DE, Hudson DO, Wininger JM, Richardson BD: Penetration of laser light at 808 and 980 nm in bovine tissue samples. Photomed Laser Surg, 2013; 31(4): 163–68
- 22. Arza RA: Upper and lower respiratory conditions. In: Riegel RJ, Godbold JC (eds.), Laser therapy in veterinary medicine. Hoboken: John Wiley & Sons, Inc., 2017; 150–60
- 23. Vatankhah Z, Mokmeli S, Boshbishe S: Evaluation of the effect of low-lev- el laser therapy (LLLT) in the treatment of asthma, added to convention- al drug therapy (crossover, case control clinical trial). Photodiagnosis and Photodynamic Therapy, 2008; 5(Suppl. 1): S22
- 24. Community-Acquired Pneumonia Severity Index (PSI) for Adults; Community- Acquired Pneumonia Severity Index (PSI) for Adults Calculator. https://www.merckmanuals.com/medical-calculators/CommunityAcqPneumonia.htm
- 25. Charles PG, Wolfe R, Whitby M et al: SMART-COP: A tool for predicting the need for intensive respiratory or vasopressor support in community-ac- quired pneumonia. Clin Infect Dis, 2008; 47(3): 375–84
- 26. Duca A, Piva S, Focà E et al: Calculated decisions: Brescia-COVID Respiratory Severity Scale (BCRSS)/algorithm. Emerg Med Pract, 2020; 22(5 Suppl.): CD1–2
- 27. El Moussaoui R, Opmeer BC, Bossuyt PM et al: Development and valida- tion of a short questionnaire in community acquired pneumonia. Thorax, 2004; 59(7): 591–95
- 28. Zimatore C, Pisani L, Lippolis V et al: The radiographic assessment of lung edema (RALE) score has excellent diagnostic accuracy for ARDS. Eur Respir J, 2019; 54(Suppl. 63): OA3299
- 29. Wong HYF, Lam HYS, Fong AH et al: Frequency and distribution of chest radiographic findings in patients positive for COVID-19. Radiology, 2020; 296(2): E72–78
- 30. Phua J, Weng L, Ling L et al: Intensive care management of coronavirus dis- ease 2019 (COVID-19): challenges and recommendations [published cor- rection appears in Lancet Respir Med. 2020 May;8(5): e42]. Lancet Respir Med, 2020; 8(5): 506–17
- 31. Micheli L, Cialdai F, Pacini A et al: Effect of NIR laser therapy by MLS-MiS source against neuropathic pain in rats: In vivo and ex vivo analysis. Sci Rep, 2019; 9(1): 9297
- 32. Micheli L, Di Cesare Mannelli L, Lucarini E et al: Photobiomodulation ther- apy by NIR laser in persistent pain: An analytical study in the rat. Lasers Med Sci, 2017; 32(8): 1835–46
- 33. Monici M, Cialdai F, Ranaldi F et al: Effect of IR laser on myoblasts: A pro- teomic study. Mol Biosyst, 2013; 9(6): 1147–61
- 34. Henderson WR, Griesdale DE, Dominelli P, Ronco JJ: Does prone position- ing improve oxygenation and reduce mortality in patients with acute re- spiratory distress syndrome? Can Respir J, 2014; 21(4): 213–15
- 35. Guérin C, Reignier J, Richard JC et al: Prone positioning in severe acute re- spiratory distress syndrome. N Engl J Med, 2013; 368(23): 2159–68